
科目:高中化学 来源: 题型:选择题
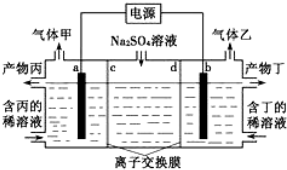
| A. | a电极反应式:2H++2e-=H2↑ | |
| B. | 产物丁为NaOH | |
| C. | c为阳离子交换膜 | |
| D. | 每转移0.2mol电子,产生1.12L气体甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负价 | -2 | -3 | -1 | -3 | |||||
| A. | 电负性的大小:⑥<②<④<⑤ | |
| B. | 单质熔点的高低:②<⑥ | |
| C. | 第一电离能的大小:③<⑧<⑦<① | |
| D. | 最高价氧化物对应水化物的酸性强弱:④<⑤<⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
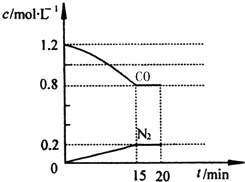
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 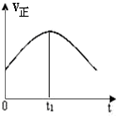 | B. | 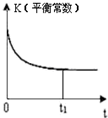 | C. | 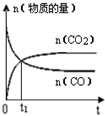 | D. | 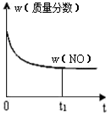 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
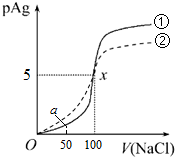
| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | Kφ(AgCl)=1×10-10 | |
| C. | a点时,溶液中c(Cl-)=1.2×10-9mol•L-1 | |
| D. | 若把0.1mol•L-1的NaCl溶液换成0.1mol•L-1的NaI溶液,则pAg的变化图象变成曲线② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
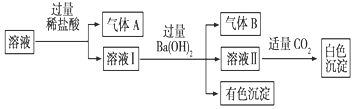
| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+离子 | |
| D. | 溶液中一定不存在大量Na+离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com