
【题目】下列分离或提纯物质的方法正确的是
A. 用蒸馏的方法分离水和油的混合物
B. 用分液的方法分离酒精和水的混合物
C. 用过滤的方法除去NaCl溶液中含有的少量泥沙
D. 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】开发太阳能资源,寻求经济发展的新动力是目前各国政府均很重视的工作。请回答下列问题:
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式:_______________________________________。
(2)多元化合物薄膜太阳能电池的材料主要为无机盐,这些无机盐包括砷化镓、硫化镉、硫化锌及铜、铟、镓、硒等。
①请比较元素的第一电离能:As_________P(填“>”“<”或“=”)。
②二氧化硒分子的立体构型为________________。
(3)镍可形成配合物Ni(CO)5,Ni(CO)5在一定条件下发生分解反应:Ni(CO)5(s)![]() Ni(s)+5CO(g),反应产物中Ni形成的金属晶体内部原子堆积方式与铜相同,则Ni金属晶体晶胞空间利用率为________________,则Ni原子配位数为________________。
Ni(s)+5CO(g),反应产物中Ni形成的金属晶体内部原子堆积方式与铜相同,则Ni金属晶体晶胞空间利用率为________________,则Ni原子配位数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A. 高温及加入催化剂都能使合成氨的反应速率加快
B. 红棕色的NO2加压后颜色先变深后变浅
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. H2、I2、HI平衡时的混合气体加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯化物中既能由单质直接化合制得,又可由金属和盐酸反应制得的是( )
A. CuCl2 B. FeCl2 C. FeCl3 D. AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的
ClO-将CN-氧化为两种无污染的气体,下列说法正确的是
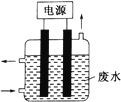
A. 可以用铁作阳极,石墨作阴极
B. 除去CN-的反应:2CN-+5ClO-+ H2O =N2↑+2CO2↑+5Cl-+2 OH-
C. 阴极的电极反应式为:Cl-+2OH-+2e-= ClO-+H2O
D. 阳极的电极反应式为:2CN-+12OH--10e-= N2↑ +2CO32-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.1mol·L-1的NaOH溶液分别滴定体积均为10.00mL浓度均为0.1mol·L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。
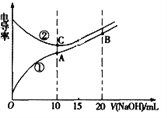
回答下列问题:
(1)曲线_______代表滴定CH3COOH溶液的曲线。
(2)在相同温度下,A、B、C三点溶液中水电离的c(H+)从大到小顺序为: ___________________。
(3)若室温下,当NaOH溶液滴定CH3COOH溶液恰好使溶液PH=7时, 消耗NaOH溶液为V L,则V取值应在 ___处,
A.0 – 5mL B.5 – 10mL C.10 –1 5mL D.15 – 20mL
CH3COOH溶液的电离平衡常数Ka用V表示为 Ka = _______(忽略混合时溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硝酸氧化淀粉水解的产物(C6H12O6)可以制备草酸,装置如下图所示(加热、搅拌和仪器固定装置均己略去)。
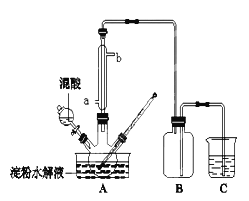
实验过程如下:
①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,得到淀粉水解液,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入少许98%硫酸的目的是:_____________________。
(2)冷凝水的进口是________(填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是______________________。
(3)装置B的作用是___________,为使尾气被充分吸收,C中的试剂是___________。
(4)重结晶时,将草酸晶体粗品经I加热溶解、Ⅱ趁热过滤、Ⅲ冷却结晶、Ⅳ过滤洗涤、Ⅴ干燥等实验步骤,得到较纯净的草酸晶体。该过程中可将粗品中溶解度较大的杂质在_________(填上述实验步骤序号)时除去;而粗品中溶解度较小的杂质最后留在_______(填“滤纸上”或“滤液中”)。
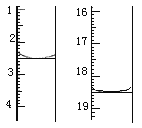
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。称取一定量该样品加适量水完全溶解,用KMnO4标准液滴定,反应的离子方程式为_________________。 滴定前后滴定管中的液面读数如图所示,则消耗KMnO4溶液的体积为_________。
(6)已知草酸是一种二元弱酸,草酸氢钠溶液(NaHC2O4)显酸性。常温下,向10 mL0.01 mol L -1IH2C2O4溶液中加入10mL0.01mol·L-1NaOH溶液时,溶液中各种离子的浓度由大到小的顺序为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com