
| A. | PBr3、NO2 | B. | CH4、SCl2 | C. | BF3、SO2 | D. | H2O、CS2 |
分析 根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型.
解答 解:A、P原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp3杂化,故A错误;
B、C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,故B错误;
C、BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp2杂化;SO2中S原子杂化轨道数=δ键数+孤对电子对数=2+1=3,所以采取sp2杂化,故C正确;
D、O原子杂化轨道数=δ键数+孤对电子对数=2+2=4,所以采取sp3杂化,故D错误,
故选C.
点评 本题考查了原子杂化类型的判断,难度不大,根据“杂化轨道数=δ键数+孤对电子对数”来解答即可,原子杂化类型的判断是高考的热点,所以是学习的重点.


科目:高中化学 来源: 题型:解答题
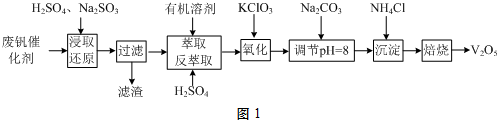
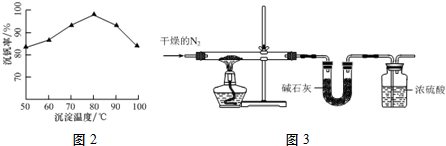
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
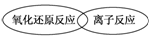 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
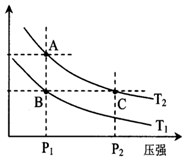 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
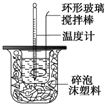
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
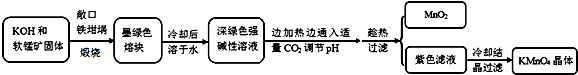
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
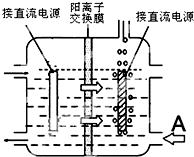
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com