
分析 无色透明的溶液中只含有NH4+、Cl-、H+、OH-4种离子;
该溶液的溶质组分可能是①NH4Cl,溶液中铵根离子水解溶液显酸性;
该溶液的溶质组分可能是②NH4Cl,NH3•H2O,两种溶质的物质的量之比为1:1,一水合氨电离大于铵根离子水解,溶液呈碱性;
该溶液的溶质组分可能是③NH4Cl,HCl,两种溶质的物质的量之比为1:1,溶液显酸性,氢离子对铵根离子水解抑制.
解答 解:该溶液的溶质组分可能是①NH4Cl,溶液中铵根离子水解溶液显酸性,溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
该溶液的溶质组分可能是②NH4Cl、NH3•H2O,两种溶质的物质的量之比为1:1,一水合氨电离大于铵根离子水解,溶液呈碱性,溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
若该溶液应为HCl和NH4Cl溶液,溶液显酸性,离子浓度大小为,c(Cl-)>c(H+)>c(NH4+)>c(OH-),
故答案为:Cl-,NH4+,H+,OH-;NH4+,Cl-,OH-,H+;Cl-,H+,NH4+,OH-,
点评 本题考查离子浓度大小的比较,熟悉溶液中的电荷守恒及物料守恒是解答本题的关键,注意溶液中溶质的判断及离子的水解为解答的难点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
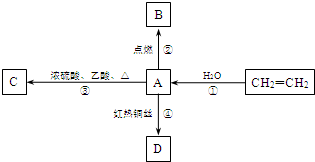 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化. CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.
CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物中含有的化学键是共价键、离子键.
,该化合物中含有的化学键是共价键、离子键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 限制使用电动车 | |
| B. | 利用太阳能、风能和氢能等能源代替化石燃料 | |
| C. | 鼓励私人购买和使用汽车代替公交车 | |
| D. | 以煤等燃料作为主要生活燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com