
分析 (1)依据浓度商计算和平衡常数比较分析反应进行的方向,注意固体不写入平衡常数和浓度商的计算式子,根据化学三段式列式计算平衡浓度;
(2)依据(1)的计算,结合转化率是消耗量除以起始量计算CO的转化率.
解答 解:(1)FeO(s)+CO(g)=Fe(s)+CO2(g)的K=0.5(1273K).若起始浓度c(CO)=0.05mol/L,c(CO2)=0.01mol•L-1,浓度商Q=$\frac{c(C{O}_{2})}{c(CO)}$═$\frac{0.01mol/L}{0.05mol/L}$=0.2<0.5,说明反应向正向反应进行;依据化学平衡三段式列式计算,设消耗一氧化碳浓度为x,
FeO(s)+CO(g)=Fe(s)+CO2(g)
起始量(mol/L) 0.05 0.01
变化量(mol/L) x x
平衡量(mol/L) 0.05-x 0.01+x
则:K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.01+x}{0.05-x}$=0.5,
解得:x=0.01mol/L,
平衡后各物质的浓度c(CO2)=0.01mol/L+0.01mol/L=0.02mol/L,c(CO)=0.05mol/L-0.01mol/L=0.04mol/L,
答:化学反应向正反应方向进行,一氧化碳浓度为0.04mol/L,二氧化碳浓度为0.02mol/L;
(2)一氧化碳的转化率=$\frac{0.01mol/L}{0.05mol/L}$×100%=20%,
答:平衡后一氧化碳的转化率为20%.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
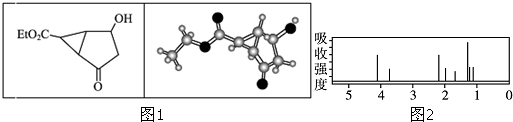
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 利用质谱法不能确定该有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mL浓氨水加水稀释至l00mL后,溶液中n(OH-)减少 | |
| B. | 室温时,0.1 mol•L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O?HCO3-+OH-向正反应方向移动,则溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水氨水食盐水都能导电,所以Cl2、NH3和氯化钠都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向正向移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
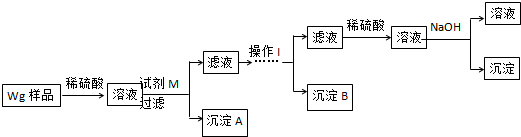
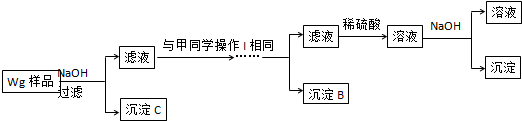
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下,0.0l mol/L醋酸溶液的pH=4 | |
| B. | 该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10 | |
| C. | 该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7 | |
| D. | 该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH>4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.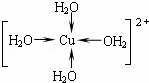 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 101 kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com