
【题目】金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是( )
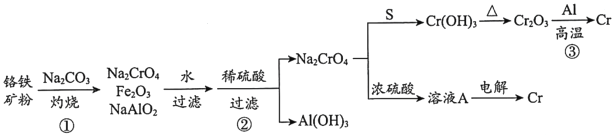
A.①中需持续吹入空气作氧化剂B.②中需加入过量稀硫酸
C.③中发生了置换反应D.溶液A为橙色
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是
A.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)![]() N2O4(g) ΔH<0
N2O4(g) ΔH<0
B.NH4Cl溶液显酸性:NH4++2H2O=NH3·H2O+H3O+
C.向Mg(OH)2悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2NH4+=Mg2++2NH3·H2O
D.用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
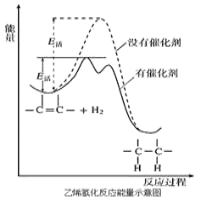
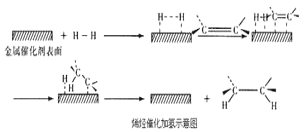
下列说法中正确的是( )
A.乙烯和H2生成乙烷的反应是放热反应
B.加入催化剂,可减小反应的热效应
C.催化剂能改变平衡转化率,不能改变化学平衡常数
D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) CO2与NH3反应可合成化肥尿素。已知:
①2NH3(g)+CO2(g) = NH2CO2NH4(s) ΔH= -159.5kJmol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+H2O(g) ΔH= +116.5kJmol-1
③H2O(l) = H2O(g) ΔH= +44.0kJmol-1
写出CO2与NH3合成尿素[CO(NH2)2]和液态水的热化学反应方程式_____
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当1mol Cl2参与反应时释放145kJ的热量,写出这个反应逆反应的热化学方程式:______ 。
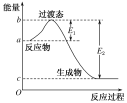
(3)下图是1mol NO2(g)与1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。
(4)已知H—H键、N≡N键、N-H键的键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/(kJ·mol-1) | 436 | 946 | 391 |
则反应N2(g)+3H2(g)=2NH3(g)的 ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A. 3v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是
A. 向纯水中投入一小块金属钠B. 将水加热煮沸
C. 向水中通入SO2D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的烟气中含有SO2和NOx,用NaOH、NaClO、Ca(ClO)2等溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(1)下列关于吸收SO2过程发生的有关反应,用下列方程式表示:
①SO2(g)+2OH-(aq)=SO![]() (aq)+H2O(l) k1
(aq)+H2O(l) k1
②ClO-(aq)+SO![]() (aq)=SO
(aq)=SO![]() (aq)+Cl-(aq) k2
(aq)+Cl-(aq) k2
③CaSO4(s)=Ca2+(aq)+SO![]() (aq) k3
(aq) k3
k1、k2、k3分别表示反应①、②、③的化学平衡常数,则反应:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的化学平衡常数K=___(用k1、k2、k3表示)。
(2)标准状况下,把SO2通入11.2mL水中制得饱和溶液,测得其pH=0.74。已知:标准状况下SO2在水中的溶解度按体积比为1:67.2(即V(H2O):V(SO2)=1:67.2)。
①写出该溶液中存在的电离平衡___。
②已知饱和溶液中的SO2有![]() 与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
(3)SO2的水溶液中存在歧化反应:3SO2+2H2O=2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:
a:SO2+4I-+4H+=S↓+2I2+2H2Ob:I2+2H2O+SO2=SO42-+2I-+4H+
欲探究反应a和b的反应速率与歧化反应的速率的关系,设计实验如下:将18mLSO2的水溶液分别加入2mL下列试剂中,密闭放置,观察现象。(已知I2易溶于KI溶液,溶液呈棕褐色)
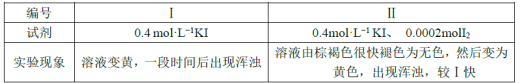
完成下列问题:
①由实验现象可得出反应a与反应b的速率:v(a)___v(b)(填“>”“﹤”或“=”)。
②测得反应3SO2+2H2O=2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示___(填物质的名称)的变化。该反应在实验Ⅰ条件下进行,15min时达到化学平衡状态,用SO2表示该反应前15min内的平均反应速率为___mol·L-1·min-1。

③下列叙述能说明3SO2(aq)+2H2O(l)=2H2SO4(aq)+S(s)反应已达到平衡状态的是____填字母)。
A.生成1.5molSO2的同时消耗1molH2SO4
B.反应过程中,溶液中的分子总数不再变化
C.恒温恒容时,混合溶液中硫酸的密度保持不变
D.绝热恒容时,反应的化学平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
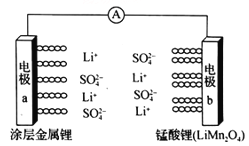
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已部分被氧化、质量为0.77 g的钠放入10 g水中后,收集到氢气0.02 g。
(1)金属钠表面氧化钠的质量是________。
(2)所得溶液里溶质的质量分数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com