
【题目】X,Y,Z,W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( ) ![]()
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下:
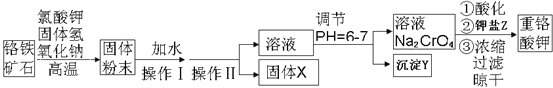
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有_________。铁在周期表的位置是_________。
(2)煅烧前应将铬铁矿充分粉碎,其目的是___________________________。
如在实验室中将铬铁矿和NaOH固体混合物灼烧,从以下各实验仪器中选择必要有_________。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角
(3)操作Ⅱ的名称是__________________。
(4)固体X的主要成分是__________________,沉淀Y的主要成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为:

在T℃时,向2.0 L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是 ( )
A. 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol·L-1·min-1
B. 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH<0
C. 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 mol α-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行
D. 在T℃时,起始时若向容器中充入2.0mol α-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的位置如表所示.下列说法不正确的是( ) 
A.甲、丁、戊的单质都是金属
B.乙、丙、辛都是非金属元素
C.乙、庚、辛都能形成氧化物
D.已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 单体的质量之和等于所生成的高分子化合物的质量
B. 单体为一种物质时,则单体发生加聚反应
C. 缩聚反应的单体至少有两种物质
D. 淀粉和纤维素的聚合度不同,不互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示:

难溶金属氢氧化物的S-pH图
(1)pH=3时溶液中铜元素的主要存在形式是___________________________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是________________________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:_________________________________________________________。
(5)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________(填选项)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)![]() (绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是________________________;

(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如上图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应_____________________;
②由图可知,溶液酸性增大,CrO42-的平衡转化率________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________;
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示滴定终点的到达。当溶液中Cl-恰好沉淀完全(Cl-浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO![]() )等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中c(CH3COOH)/c(H+)值减小
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,关于 ![]() Y的说法正确的是( )
Y的说法正确的是( )
A.钇在周期表中的位置是第4周期ⅢB族
B.属于非金属元素
C.![]() Y和
Y和 ![]() Y是两种不同的核素
Y是两种不同的核素
D.中子数为39
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com