
| |||||||||||||||
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2007届江阴市高三化学第一次模拟试题(人教) 人教 题型:058
| |||||||||||
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的电池,人们普遍认为铝是负极。某研究性学习小组为探究该电池中究竟哪种金属作负极、发生了怎样的电极反应,进行了如下实验:
如图剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。
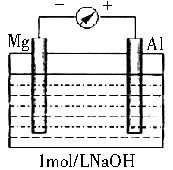
开始,电表指针向右偏转约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。
根据以上实验现象,回答下列问题:
(1)开始阶段,电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是______;负极发生的电极反应是______________________。
(2)随后阶段,铝片发生的电极反应式是_________________;镁条表面只有极少量的气泡产生,其原因是2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是____________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
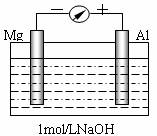
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是____(填“Mg”或“Al”)片;铝片表面产生的气泡是____;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,剪取约8 cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500 μA的教学演示电表的“-”“+”端相连接,迅速将两电极插入盛有1 mol·L-1 NaOH溶液的烧杯中。
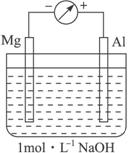
开始,电表指针向右偏移约500 μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400 μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。
根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是__________(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的电极反应是________________________________________。
(2)随后阶段,铝片发生的电极反应式是__________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-====H2↑+2OH-(极少),试判断此电极发生的主要反应是__________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com