
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
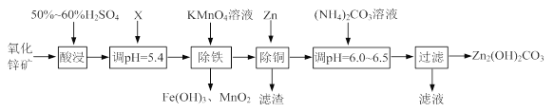
(1)“酸浸”时保持H2SO4过量的目的是_____。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:_____。
②流程中调节pH=5.4所加试剂X为_____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为_____(填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为_____。

【答案】提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解) 3Fe2++ MnO4-+7H2O=3Fe(OH)3↓ + MnO2 ↓+5H+ ZnO(或答碱式碳酸锌、碳酸锌、氢氧化锌、氨水等均给分) 不能;强酸性条件下KMnO4被还原成Mn2+,在除去Mn2+时,会使Zn2+同时沉淀 (NH4)2SO4 Zn2(OH)2CO3 + 2H2S=2ZnS↓+CO2↑+3H2O
【解析】
(1)“酸浸”时,硫酸与ZnO、FeCO3、CuO反应,生成硫酸盐等,溶液中存在金属阳离子,均会发生水解反应,所以酸浸时硫酸过量的目的是提高矿石的浸出率,防止Zn2+、Fe2+、Cu2+等金属离子水解;
(2)①由流程图可知,加入高锰酸钾除铁时,Fe元素以氢氧化铁的形式除去,同时生成二氧化锰,所以加入KMnO4溶液除铁的离子方程式是3Fe2++ MnO4-+7H2O=3Fe(OH)3↓ + MnO2 ↓+5H+;
②最终的产物是碱式碳酸锌流程中调节pH=5.4所加试剂X既能除去过量的硫酸调节溶液的pH又不能引入新的杂质,所以X只能是ZnO或碱式碳酸锌、碳酸锌、氢氧化锌等;
试剂X与高锰酸钾不能互换,因为在酸性条件下,高锰酸根离子被还原为锰离子,而锰离子沉淀时的pH=8.1>5.4,此时Zn2+也会沉淀,所以不能互换;
(3)由流程图可知,除铜后的溶液中的溶质为硫酸锌,加入碳酸铵后,主要得到碱式碳酸锌和硫酸铵,硫酸铵可做化肥,所以滤液中的溶质是(NH4)2SO4;
(4)碱式碳酸锌吸收硫化氢后得到ZnS沉淀,同时又二氧化碳、水生成,过滤后可达到除硫的目的,所以碱式碳酸锌吸收硫化氢的化学方程式为Zn2(OH)2CO3 + 2H2S=2ZnS↓+CO2↑+3H2O。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是( )
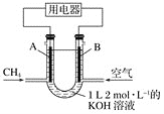
A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4 L时,电池总反应的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O
C.22.4 L<V≤44.8 L时,负极电极反应为CH4-8e-+![]() +3H2O=
+3H2O=![]()
D.V=33.6 L时,溶液中只存在阴离子![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)有广泛的用途,实验室中通过如下方法制备:
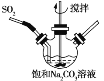
①不断搅拌条件下,在饱和Na2CO3溶液中缓缓通入SO2至反应完全;
②取下三颈烧瓶,测得反应液的pH=4.1;
③将溶液蒸发浓缩、结晶、过滤得焦亚硫酸钠晶体。
请回答下列问题:
(1)实验室可利用Na2SO3和较浓的硫酸制备少量SO2气体,该反应的化学方程式为_______________。硫酸浓度太大不利于SO2气体逸出,原因是_____________。制备、收集干燥的SO2气体时,所需仪器如下。装置A是气体发生装置,按气流方向连接各仪器口,顺序为a→____→____→____→____→f。装置D的作用是__________。

(2)步骤①反应的离子方程式为________________,合成Na2S2O5的总化学方程式为__________________。
(3)在强碱性条件下利用Na2S2O5氧化HCOONa的方法可制备保险粉连二亚硫酸钠(Na2S2O4),反应的离子方程式为___________。
(4)工业上用焦亚硫酸钠法制备保险粉带来的主要问题是废水中含有大量的有机物,有机物总含碳量用TOC表征,常采用Fenton 氧化法去除废水中的有机物,即通过向废水中加入H2O2,以Fe2+作催化剂,产生具有强氧化性的羟基自由基(·OH)来氧化降解废水中的有机物。
①其他条件一定时,n(H2O2 )∶n(Fe2+)的值对TOC 去除效果的影响如图1所示:

当TOC的去除率最大时,n(H2O2)∶n(Fe2+)=____。
②在pH=4.5,其他条件一定时,H2O2的加入量对TOC 去除效果的影响如图2所示,当H2O2的加入量大于40 mL·L-1时,TOC 去除率反而减小的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.马口铁(镀锡铁皮)镀层破损后铁仍不易腐蚀
B.CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS)
D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______。
(3)与CN-互为等电子体的一种分子为______(填化学式);1mol Fe(CN)63-中含有σ键的数目为______。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______(填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
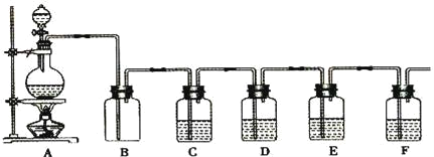
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
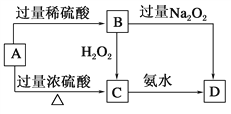
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其工业制备原理如图1。以Pd/Al2O3为催化剂,在相同反应时间内,测得不同温度下(其他条件相同)环戊二烯转化率与环戊烯产率的变化曲线如图2。下列说法正确的是()

A.环戊二烯的转化率越大,越有利于环戊烯的生成
B.a点是主反应的平衡转化率,b点是副反应的平衡转化率
C.30℃~35℃之间环戊烯产率变化趋势与环戊二烯转化率不一致,原因是主反应被抑制,使环戊烯产率降低
D.30℃时催化剂的选择性最好,有利于提高生成环戊烯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
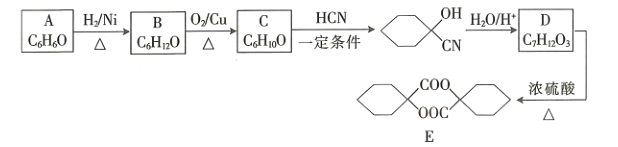
【题目】塑料、橡胶等材料的交联剂E的合成路线如图所示:
回答下列问题:
(1)B的名称为____________________。
(2)C生成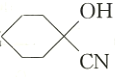 的反应类型是_________________,D中官能团的名称是________________。
的反应类型是_________________,D中官能团的名称是________________。
(3)D生成E的化学方程式为_____________________。
(4)E的同分异构体中符合下列条件的有______________种。(不考虑立体异构)
a.属于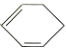 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.能够与![]() 溶液反应产生
溶液反应产生![]()
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为_______________。
(5)参照题干中合成路线,设计以丙酮为主要原料制备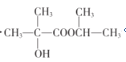 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com