
| A. | 为使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上 | |
| C. | 为加速固体物质的溶解只能采用加热的方法 | |
| D. | 为增大气体物质的溶解度,常采取搅拌、加热等措施 |
科目:高中化学 来源: 题型:解答题
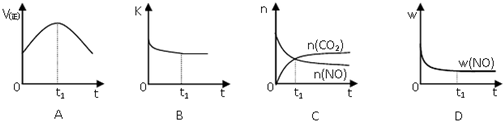
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要配制浓度为0.25mol•L-1的NaOH溶液480mL,应称量4.8g NaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 | |
| B. | 配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 | |
| C. | 配制一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高 | |
| D. | 配制20g密度为ρg•cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为25ρ/41mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b且pH(NaX)>pH(NaY),则酸性HX<HY | |
| B. | 若a=b且c(X -)=c(Y -)+c(HY),则酸性HX>HY | |
| C. | 若a>b且c(X -)=c(Y -),则酸性HX<HY | |
| D. | 若a=0.1mol/L且两溶液等体积混合,则c(X -)+c(HX)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
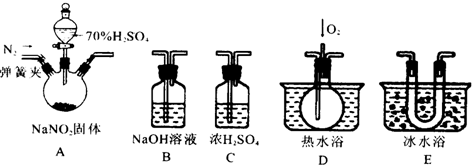
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
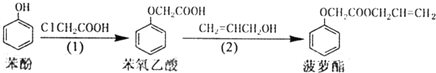
| A. | 步骤(1)、(2)的反应类型不同 | |
| B. | 步骤(1)产物中残留的苯酚能用FeCl3溶液检验 | |
| C. | 苯氧乙酸和菠萝酯均可与氢氧化钠溶液反应 | |
| D. | 步骤(2)产物中残留的烯丙醇不能用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
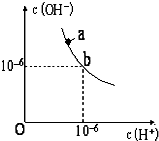 回答下列问题.
回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com