
(16+2分)目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平: ;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验2条件下的H2O 体积分数为 ;
②下列方法中可以证明上述已达平衡状态的是 ;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,

下列说法正确的是________。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH—)相等
B.①点时pH=6,此时溶液中,c(CH3COO—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO—)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO—)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式 ;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
(1)C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O (2) 20﹪ ae 0.36
(3)2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ·mol-1
(4)BC (5)CO-2e-+CO32-=2CO2 D
【解析】
试题分析:(1)在反应中,杂质碳被氧化为无污染气体而除去,则该气体是CO2,Mn元素转变为Mn2+,因此反应的化学方程式为C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O;
(2)①根据表中数据可知,平衡时氢气的物质的量是0.4mol,则根据方程式可知消耗水蒸气的物质的量是0.4mol,剩余水蒸气的物质的量是0.6mol。反应前后体积不变,所以实验2条件下的H2O 体积分数为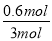 ×100%=20%;
×100%=20%;
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则a .单位时间内生成n mol H2的同时生成n mol CO反应速率的方向相反,且满足速率之比是相应的化学计量数之比,能说明反应达到平衡状态;b. 反应前后体积不变,压强始终不变,因此容器内压强不再变化不能说明反应达到平衡状态;c. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终不变,所以混合气体密度不再变化不能说明反应达到平衡状态;d.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,在反应过程中质量和物质的量均是不变,所以相对分子质量始终不变,则混合气体的平均相对分子质量不再变化不能说明反应达到平衡状态;e. CO2的质量分数不再变化说明反应达到平衡状态,答案选ae。
③根据表中数据可知反应C(s)+2H2O(g)=CO2(g)+2H2(g)减去C(s)+H2O(g)=CO(g)+H2(g)即得方程式CO(g)+H2O(g) CO2(g)+H2(g),该反应平衡常数的对数值(lgK)=-0.03-(-0.39)=0.36;
CO2(g)+H2(g),该反应平衡常数的对数值(lgK)=-0.03-(-0.39)=0.36;
(3)已知① C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,② CO2(g)+C(s)=2CO(g) △H2=+172.5kJ/mol,③ S(s)+O2(g) =SO2(g) △H3=-296.0kJ/mol,则根据盖斯定律可知①-②-③即得到2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ/mol。
(4)A、醋酸抑制水的电离,而醋酸钠水解促进水的电离,因此pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH—)不相等,A错误;B、①点时pH=6,根据电荷守恒c(CH3COO—)+ c(OH—)=c(H+)+c(Na+)可知此时溶液中c(CH3COO—)-c(Na+)=c(H+)-c(OH—)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,B正确;C、②点时pH=7,溶液显中性,则根据电荷守恒c(CH3COO—)+ c(OH—)=c(H+)+c(Na+)可知溶液中的c(CH3COO—)=c(Na+),C正确;D、③点时V=20mL,二者恰好反应生成醋酸钠,溶液显进行,因此溶液中c(CH3COO—)<c(Na+)=0.05mol/L,D错误,答案选BC。
(5)①A电极通入的是CO,属于负极。由于电解质是以Li2CO3和Na2CO3熔融的混合物,所以碳酸根离子向负极移动,则负极反应式为CO-2e-+CO32-=2CO2;
②粗铜精炼时粗铜与电源的正极相连作阳极,纯铜与电源的负极相连作阴极,所以B极应该与D电极相连。
考点:考查氧化还原反应方程式、平衡常数、平衡状态判断、盖斯定律由于、酸碱中和反应以及电化学原理的应用


科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第三次月考化学试卷(解析版) 题型:选择题
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变
D.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:填空题
(本题共12分) 芳香烃都含有苯环,其中二个或二个以上的苯环共用相邻碳原子的叫“稠环芳烃”。
43.菲的分子式是C14H10,是一种稠环芳烃,结构如图 。它的一氯代物有 种。
。它的一氯代物有 种。
44.以下有机物分子式都为C13H12,且都含有两个苯环和一个侧链。
(1)其中不能使溴水褪色的有4种,其中一种为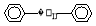 ,试再写出另一种的结构简式____________。
,试再写出另一种的结构简式____________。
(2)写出1种符合以下条件的物质的结构简式________________。
①属稠环芳烃 ②含有-CH2CH=CH2基团
45.写出将环己烯通入下列两种溶液后出现的现象。
(1)通入溴水: (2)通入溴的四氯化碳溶液: 。
46.在苯和苯酚的溴化反应中,有三个方面可说明羟基对苯环取代反应的“活化”作用:
①苯要用铁为催化剂,而苯酚不须用催化剂;② ;
③ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.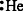 B.
B. C.1s2 D.
C.1s2 D.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:选择题
下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:填空题
(16分)兔耳草醛是食品与化妆品工业中的香料添加剂,可利用下列路线合成:
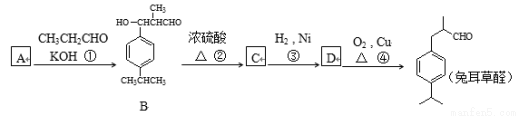
已知:① CH3CHO+CH3CHO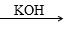 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO
②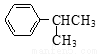 可写成
可写成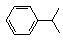
③羟基与碳碳双键两端的碳原子相连时不稳定。
(1)写出CH3CH2CHO的两种链状同分异构体 , B的官能团名称是 ;
(2)A的结构简式为 ,反应②的反应类型 ;
(3)鉴别B和C两种物质可以使用的化学试剂是 ;
(4)由D生成兔耳草醛的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
下图为可逆反应A(g)+2B(g) n C(g)( ΔH<0),生成物C的浓度随压强变化并建立平衡的关系图,
n C(g)( ΔH<0),生成物C的浓度随压强变化并建立平衡的关系图,
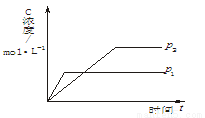
则n值与压强p1、p2的关系正确的是
A.p2>p1,n<3 B.p2>p1,n>3
C.p1>p2,n<3 D.p1>p2,n>3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
A.所含分子数和质量均不相同
B.含有相同的分子数和电子数
C.含有相同的质子数和中子数
D.含有相同数目的中子、原子和分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com