
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③ |
分析 ①ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键;
②醇、羧酸与水分子之间能形成氢键;
③冰中存在氢键,其体积变大;
④稳定性与化学键有关;
⑤对羟基苯甲酸易形成分子之间氢键.
解答 解:①因第ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键,则NH3的熔、沸点比VA族其他元素氢化物的高,故①正确;
②小分子的醇、羧酸与水分子之间能形成氢键,则可以和水以任意比互溶,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,故④错误;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤正确;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
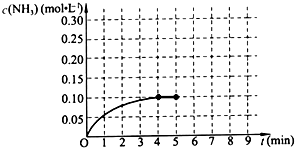 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用酒精清洗银器表面的氧化膜 | |
| C. | 用米汤检验含碘盐中的碘酸钾(KIO3) | |
| D. | 用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大自然利用太阳能最成功的是植物的光合作用 | |
| B. | H2是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用 | |
| C. | 海水淡化技术的进步有助于淡水资源紧缺问题的解决 | |
| D. | 利用工业废气中的CO2制造全降解塑料,符合绿色环保要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体A的物质的量不再随时间而改变 | |
| B. | 容器内气体C的浓度不再随时间而改变 | |
| C. | 单位时间内生成amol物质A,同时生成2amol物质B | |
| D. | 单位时间内生成amol物质A,同时生成2amol物质C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③⑤⑥ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单地说,金属的冶炼就是把金属单质从其矿物中分离出来 | |
| B. | 金属冶炼过程中,被冶炼的金属只能被氧化 | |
| C. | 金属冶炼过程中,被冶炼的金属只能被还原 | |
| D. | 金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com