
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 .
(2)上述反应中的还原剂是 , 反应产生的气体可用吸收,吸收过程中发生的反应的离子方程式为 .
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2 , 写出该反应的化学方程式并用单线桥法表示电子转移的方向和数目:;
(4)若其氧化产物的总物质的量比还原产物的总物质的量少0.8mol,则反应中转移电子的物质的量为 .
【答案】
(1)1:1
(2)SnCl2;NaOH溶液;H2S+2OH﹣=2H2O+S2﹣、S2﹣+H2S=2HS﹣
(3)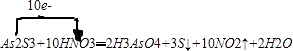
(4)1.6mol
【解析】解:(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1,所以答案是:1:1;(2)反应中SnCl2中的Sn元素化合价升高,SnCl2为还原剂,H2S为酸性气体,可用NaOH溶液吸收,离子反应方程式为:H2S+2OH﹣=2H2O+S2﹣、S2﹣+H2S=2HS﹣ , 所以答案是:SnCl2;NaOH溶液;H2S+2OH﹣=2H2O+S2﹣、S2﹣+H2S=2HS﹣;(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2 , 所以反应的化学方程式为:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,用单线桥法表示电子转移的方向和数目为: 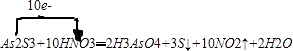 ,所以答案是:
,所以答案是: 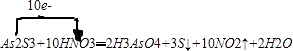 ;(4)设反应中转移电子的物质的量为x, 2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,转移电子 氧化产物和还原产物的差
;(4)设反应中转移电子的物质的量为x, 2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,转移电子 氧化产物和还原产物的差
2 1mol
x 0.8mol
x=2×0.8=1.6mol,所以答案是:1.6mol.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】现有m g某气体,由双原子分子构成,摩尔质量为M gmol﹣1 . 若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为mol.
(2)该气体所含原子总数为个.
(3)该气体在标准状况下的体积为L.
(4)该气体在标准状况下的密度为g/L.
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法.古代有:(I)火烧孔雀石炼铜;(Ⅱ)湿法炼铜.现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁.对它们的冶炼方法的分析,不正确的是( )
A.Ⅰ,①
B.Ⅱ,②
C.Ⅲ,③
D.Ⅳ,④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下: 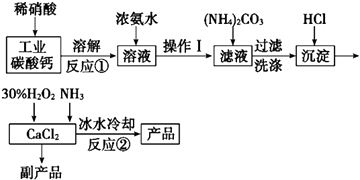
已知:CaO28H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.
(1)写出反应①中氧化还原反应的离子方程式: .
(2)向反应①后的溶液中加浓氨水的目的是: , (用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):①;② .
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.已知:I2+2S2O32﹣═2I﹣+S4O62﹣ .
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”“偏低”或“偏高”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则X离子可能为
所含离子 | NO3— | SO42— | H+ | X |
浓度mol/L | 2 | 1 | 2 | 1 |
A.Cl—B.Ba2+C.Fe2+D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
(1)从物质的分类角度来看,不恰当的一种物质是 .
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式: .
(3)“三酸”常用于溶解金属和金属氧化物.“三酸”分别溶解Fe2O3的离子方程式为:;稀硫酸、稀盐酸溶解铁的离子方程式为: .
(4)烧碱、纯碱溶液均可吸收CO2 , 当含0.1mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①;②Na2CO3;
③;④NaHCO3 .
若通入的CO2在标准状况下体积为1.792L,则得到固体的组成的化学式和物质的量分别是;将该固体全部溶于水,A、当向其中加入含0.02mol Ca(OH)2的石灰水,生成沉淀的质量为g;写出该反
应总的离子方程式:;
B、当向其中加入含0.07mol Ca(OH)2的石灰水,生成沉淀的质量为g,写出该反应总的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成以下化学方程式:(是离子反应的只写离子方程式)
(1)铁在氯气中燃烧;
(2)将二氧化硫气体通入足量的澄清石灰水中;
(3)工业上氨在催化剂作用下与氧气反应;
(4)钠与硫酸铜溶液反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,4L密闭容器内某一反应中气体M,气体N的物质的量随时间变化的曲线如图所示:
(1)比较t2时刻,正逆反应速率大小v正 v逆 . (填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:
(3)t3时刻化学反应达到平衡时反应物的转化率为
(4)如果升高温度则v逆(填增大、减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学要配制85mL 0.1molL﹣1 Na2CO3溶液.下图是一些关键步骤和操作.
(1)配制过程的先后顺序为(用字母A~F填写) .
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、、 .
(3)容量瓶上需标有:①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
A.①③⑤
B.③⑤⑥
C.①②④
D.②④⑥
(4)若用Na2CO310H2O晶体来配制溶液,需用托盘天平称量固体 .
(5)在步骤B之后,需才进行下一步操作.
(6)下列操作使配得的溶液浓度偏低的是①Na2CO310H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶用蒸馏水洗涤后未经干燥就使用 ⑥转移过程中没有洗涤烧杯
⑦定容时仰视刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com