
分析 (1)智利硝石其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物,从智利硝石分离出NaNO3,的实验步骤为溶解过滤除去不溶性杂质,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥分离得到较纯净的硝酸钠;
(2)用NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,硝酸具有氢氧化性能氧化橡胶;
(3)反应后的物质为硫酸钠、硫酸、碘单质和水,分离碘单质,可以显溶于水,溶解后利用碘单质溶解度在有机溶剂中比在水中大,采取萃取分液的方法,分离
得到有机层,应用蒸馏的方法分离出碘单质,4NaIO3+10NaHSO3→7Na2SO4+3H2SO4+2I2+2H2O,当NaIO3与NaHSO3的物质的量之比为1:2.6时,结合化学方程式定量关系可知,亚硫酸氢钠过量,生成的碘单质会氧化亚硫酸氢钠,碘单质产率=$\frac{实际量}{理论量}$×100%;
(4)现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有氮气和氢气合成氨,氨气催化氧化生成一氧化氮和水,一氧化氮已化为二氧化氮,二氧化氮溶于水生成硝酸,为充分吸收通入水中的氧气和一氧化氮体积比为3:4.
解答 解:(1)智利硝石其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物,从智利硝石分离出NaNO3,的实验步骤为溶解过滤除去不溶性杂质,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥分离得到较纯净的硝酸钠,
故答案为:过滤、蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(2)用NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,反应的化学方程式为:NaNO3+H2SO4=NaHSO4+HNO3↑,硝酸具有氢氧化性能氧化橡胶,热的硝酸会腐蚀橡胶,制取装置中应该用磨砂接口代替胶管和胶塞,
故答案为:NaNO3+H2SO4=NaHSO4+HNO3↑;磨砂接口;
(3)反应后的物质为硫酸钠、硫酸、碘单质和水,分离碘单质,可以显溶于水,溶解后利用碘单质溶解度在有机溶剂中比在水中大,采取萃取分液的方法,分离
得到有机层,应用蒸馏的方法分离出碘单质,分离出I2的操作加四氯化碳萃取、分液、水浴蒸馏,NaHSO3过多或过少,I2的产率都会降低,当NaIO3与NaHSO3的物质的量之比为1:2.6时,
4NaIO3+10NaHSO3=7Na2SO4+3H2SO4+2I2+2H2O,
4 10 2
1mol 2.5mol 0.5mol
过量的亚硫酸氢钠和生成的碘单质发生反应,2I2+2NaHSO3+2H2O=Na2SO4+4HI+H2SO4,
2 2
0.1mol 0.1mol
I2的产率=$\frac{0.5mol-0.1mol}{0.5mol}$×100%=80%;
故答案为:加四氯化碳萃取、分液、水浴蒸馏;80%;
(4)现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有氮气和氢气合成氨,氨气催化氧化生成一氧化氮和水,一氧化氮氧化为二氧化氮,二氧化氮溶于水生成硝酸,为充分吸收通入水中的氧气和一氧化氮体积比为3:4,工业制硝酸的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,4NO+3O2+2H2O=4HNO3;
故答案为:合成氨;氯碱工业;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,4NO+3O2+2H2O=4HNO3.
点评 本题考查了氮及其化合物性质的分析应用,主要是化学实验基本操作,物质分离提纯,氧化还原反应的实质理解应用,掌握基础是解题关键,题目难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. ,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为
,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为 .
.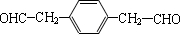 (写一种即可).
(写一种即可). 单体的结构简式为
单体的结构简式为 ;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式
;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙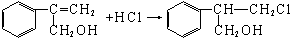 (不需注明反应条件).
(不需注明反应条件).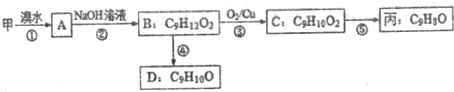
 .
. 、
、 、
、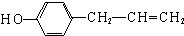 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | C5H10中只有三种属于直链烯烃的同分异构体(包括空间异构) | |
| D. | 含两个-COOCH3的有机物(C7H12O4)属于酯的同分异构体多于4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | Na2S溶液中滴加NClO溶液:S2-+ClO-+H2O═S↓+Cl-+2OH- | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
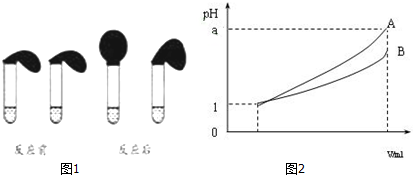
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
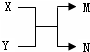
| A. | 若X为Fe,N为氢气,则Y一定为酸 | |
| B. | 若X、N为化合物,Y为水,则M一定是气体单质 | |
| C. | 若X、Y、M、N均为化合物,该反应一定属于复分解反应 | |
| D. | 若X、Y、M、N均为10电子微粒,且M是工业生产HNO3的一种原料气,则N常温下一定呈液态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com