解答:
解:(1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=
,故答案为:K=
;
(2)密闭容器中充入10mol CO和20mol H
2,达到平衡状态A时,CO转化率为0.5,此时各物质的物质的量为CO为5mol,H
2为10mol,CH
3OH为5mol,气体的物质的量为20mol,容器体积为20L;若反应开始时仍充入10mol CO 和20mol H
2,达到平衡状态B时,CO转化率为0.8,此时各物质的物质的量为CO为2mol,H
2为4mol,CH
3OH为8mol,气体的物质的量为14mol;由于A、B温度相同,化学平衡常数相同,设B点气体体积为V,则有
=
,V=4L,故答案为4;
(3)A、CO的含量保持不变,各组分的物质的量,总物质的量不变,达到化学平衡状态,故A正确;
B、容器中CH
3OH浓度与CO浓度相等,是一个比较特殊的情况,此时可能达到平衡状态,也可能未达到平衡状态,故B错误;
C、2V
正(CH
3OH)=V
正(H
2),若2V
正(CH
3OH)=V
逆(H
2),则V
正(H
2)=V
逆(H
2),达到化学平衡状态,故C正确;
D、M
平均=
,气体总质量不变,反应前后计量数不同,即反应前后气体n
总不同,所以当M
平均不变时,达到了化学平衡状态,故D正确;
故选ACD;
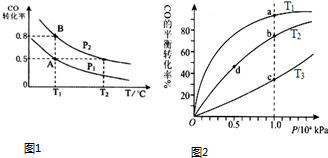
(4)A、由于该反应的正反应为放热反应,在其他条件不变的情况下,升高温度,平衡向吸热的方向移动,即向逆反应方向移动,反应物转化率降低,由于a>b>c,所以:温度:T
1<T
2<T
3,故A正确;
B、在其他条件不变的情况下,升高温度,化学反应速率加快,由于温度T
1<T
2<T
3,速率ν(c)>ν(a);在其他条件相同时,增大压强,化学反应速率加快,由于压强b>d,速率ν(b)>ν(d),故B错误;
C、化学平衡常数只与温度有关,由于T
1<T
2<T
3,升高温度,平衡向逆反应方向移动,K减小,
K(a)>K(c),K(b)=K(d),故C错误;
D、升高温度,平衡向逆反应方向移动,平衡时气体的物质的量增大,气体的平均摩尔质量减小,由于温度T
1<T
2<T
3,所以平衡时n(c)>n(a),M(a)>M(c);
在相同温度下,增大压强,平衡正向移动,平衡时气体的物质的量减小,所以平衡时n(d)>n(b),M(b)>M(d),故D错误;
故选A;
(5)将CO(g)+2H
2(g)?CH
3OH(g)△H=-90.8kJ?mol
-1与CO
2(g)+H
2(g)?CO(g)+H
2O(g)△H=+41.3kJ?mol
-1,相加可得到CO
2和H
2制取甲醇的热化学方程式CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.5 kJ?mol
-1,故答案为:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.5 kJ?mol
-1.