
| A. | 反应物所具有的总能量等于生成物所具有的总能量 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 反应达平衡后,使用催化剂,不能使平衡向右移动 | |
| D. | 当n(N2):n(H2)=1:3时,一定达化学平衡 |
分析 A.化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化,该反应为放热反应;
B.该反应是可逆反应不能进行彻底;
C.使用催化剂,平衡不移动;
D.任何化学反应中正反应速率之比等于化学计量数之比.
解答 解:A.化学反应中生成物总能量不等于反应物的总能量,反应物所具有的总能量高于生成的总能量,则反应为放热反应;反应物所具有的总能量低于生成的总能量,则反应为吸热反应,该反应为放热反应,故A错误;
B.该反应是可逆反应不能进行彻底,将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3.生成的氨气物质的量一定小于0.2mol,故B错误;
C.催化剂在反应过程中能改变反应速率,但不能使平衡向右移动,故C正确;
D.反应速率之比等于化学方程式计量数之比,反应过程中和化学平衡状态都符合,不能说明反应达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡影响因素分析,化学平衡移动原理的应用,掌握原理应用是关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
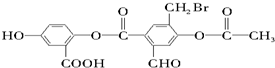 下列说法正确的是( )
下列说法正确的是( )| A. | 1 mol M最多能与10×22.4 L氢气(标准状况)发生加成反应 | |
| B. | 1 mol M最多能与2 mol Na HCO3反应 | |
| C. | 1 mol M最多能与5 mol NaOH反应 | |
| D. | 1 mol M最多能与2 mol Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
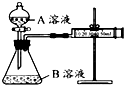 某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L-1 H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| ② | 2mL 0.1mol/L -1H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| 实验 编号 | 温度/℃ | 烧杯中所加的试剂及其用量 (mL) | 加入 少量固体 | 溶液褪色 时间(s) | |||
| 0.6mol•L-1 H2C2O4溶液 | H O | 0.2mol•L-1 KMnO4溶液 | 3mol•L-1 稀硫酸 | ||||
| ① | 25 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| ② | 50 | V1 | V2 | 30.0 | 20.0 | 无 | 1.0 |
| ③ | 25 | 15.0 | V3 | 15.0 | 10.0 | 无 | 3.6 |
| ④ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| ⑤ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 偏二甲肼既是氧化剂又是还原剂 | |
| B. | 该反应进行时只有放热过程没有吸热过程 | |
| C. | 该反应中氮元素的化合价升高 | |
| D. | 该反应中每生成1mol CO2转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是人类最早利用的金属之一,铜能形成多种重要的化合物.
铜是人类最早利用的金属之一,铜能形成多种重要的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
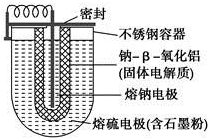 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
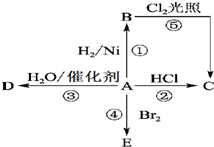 某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:
某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工作时Zn 电极质量减少 | B. | Zn 是负极,Ag2O 是正极 | ||
| C. | 工作时溶液中电子由Ag2O 流向Zn | D. | 溶液中氢氧根离子向Zn 电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com