
 ,
, ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氧化钠与盐酸反应:O2-+2H+=H2O |
| C、CaCO3悬浊液中通CO2:CO32-+CO2+H2O=2HCO3- |
| D、小苏打溶液与NaOH溶液混合:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
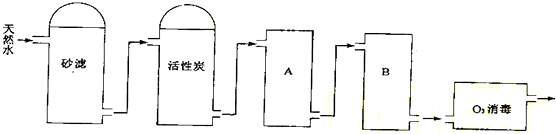
| 加入石灰 |
| 加入混凝剂通入CO2 |
| 通入气体A |
查看答案和解析>>
科目:高中化学 来源: 题型:
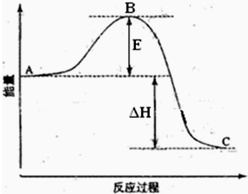 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、NO3-、K+、SO42- |
| B、Ca2+、Na+、CO32-、AlO2- |
| C、OH-、SO42-、NH4+、Al3+ |
| D、Fe3+、Mg2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com