
| A. | 锌粒与稀H2SO4的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 浓硫酸的稀释 |
科目:高中化学 来源: 题型:解答题
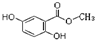 所示.
所示.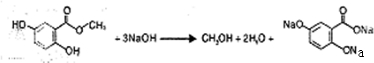 .(不用写反应条件)
.(不用写反应条件)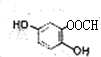 .
.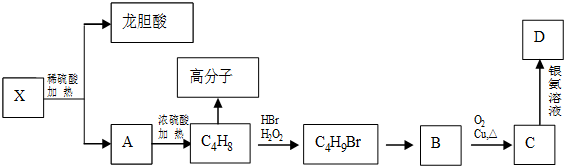
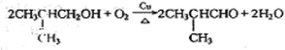 ,它的反应类型是氧化反应反应.
,它的反应类型是氧化反应反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

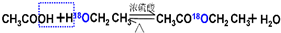 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与乙醇分别受热变为气体 | B. | 氯化钠与氯化氢分别溶解在水中 | ||
| C. | 碘与干冰分别受热变为气体 | D. | NaHSO4受热熔化与溶于水变为溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | 只有②③ | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第1列中的碱金属和第17列元素的单质熔、沸点变化趋势相同 | |
| B. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| C. | 在整个18列元素中,第14列元素形成的化合物种类最多 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
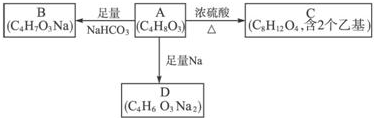
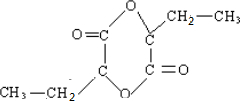 .
.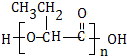 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
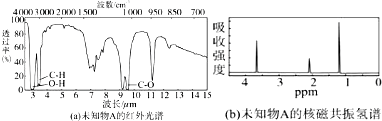
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com