
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生反应:![]()
![]() 实验测得有关数据如下表所示:
实验测得有关数据如下表所示:
容器编号 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化/kJ | ||
|
|
| ||
甲 | 2 | 1 | 0 |
|
乙 | 1.8 | 0.9 | 0.2 |
|
丙 | 0 | 0 | 2 |
|
下列判断中正确的是( )
A.![]()
B.若升高温度,反应的热效应不变
C.![]()
D.生成![]() 时放出的热量大于98.5 kJ
时放出的热量大于98.5 kJ
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是( )
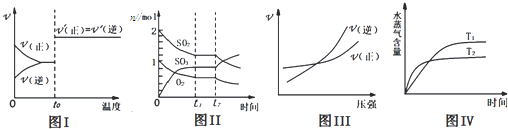
A.图I:反应H2+I22HI达平衡后,升高温度时反应速率随时间的变化
B.图Ⅱ:反应2SO2+O22SO3达平衡后,缩小容器体积时各成分的物质的量变化
C.图III:反应N2+3H22NH3在温度一定的情况下,反应速率与压强的关系
D.图IV:反应CO2(g)+H2(g)CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)元素及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态As原子的核外电子排布式为_____,砷与硒的第一电离能较大的是_____。
(2)传统中药的砷剂俗称“砒霜”,其分子结构如图所示,该化合物中As、O原子的杂化方式分别为____、_____。

(3)Na3AsO4可作杀虫剂。![]() 的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
(4)H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-溴代羰基化合物合成大位阻醚的有效方法可用于药物化学和化学生物学领域。用此法合成化合物J的路线如下:

已知:
回答下列问题:
(1)F中含有的含氧官能团的名称是______,用系统命名法命名A的名称是______。
(2)B→ C所需试剂和反应条件为___________。
(3)由C生成D的化学反应方程式是__________。
(4)写出G的结构简式_________,写出检验某溶液中存在G的一种化学方法________。
(5)F+H→J的反应类型是_______。F与C在CuBr和磷配体催化作用下也可合成大位阻醚,写出其中一种有机产物的结构简式:_______。
(6)化合物X是E的同分异构体,分子中不含羧基,既能发生水解反应,又能与金属钠反应。符合上述条件的X的同分异构体有_______种(不考虑立体异构),其中能发生银镜反应,核磁共振氢谱有3组峰,峰面积之比为1:1:6的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,CO2是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热△H为-283kJ·mol-1,CO(g)+2H2(g)![]() CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
(2)向温度不同容积均为1 L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。

①Q___(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是___。
②t2时刻时,容器b中正反应速率__(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__;
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品。
①NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-):c(CO32-)=2:1,则所得溶液的pH=___[常温下Kl(H2CO3)=4.4×10-7、K2(HCO3-)=5×10-11]。
②在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是___。
(4)用甲醇作为燃料电池的原料,请写出在碱性介质中电池负极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述是可逆反应N2(g)+3H2(g)![]() 2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
①NH3的生成速率与NH3的分解速率相等;
②单位时间内amolN2生成,同时生成3amolH2;
③N2的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦N2、H2、NH3的分子数目比为1:3:2;
A.②⑤ B.①③④⑤ C.②⑥⑦ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在2L的密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
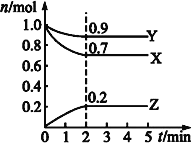
①该反应的化学方程式为______。
②若X、Y、Z均为气体,2min时反应达到平衡,此时体系内压强与开始时的压强之比为____。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时__(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4kJ/mol
②NaOH(s)+CO2(g) = NaHCO3(s) ΔH2=131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)的ΔH=____kJ/mol,不同温度下NaHCO3分解反应的平衡常数K313K____K298K(填“大于"“小于”或“等于”),该反应的平衡常数表达式K=______。
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
=____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
II.Mg﹣H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,其工作原理如图所示,电池总反应是:Mg+H2O2+2H+═ Mg2++2H2O

(1)负极材料为_____,发生___反应(填“氧化”或“还原”)
(2)两极电极反应式为:
负极:_________________;正极:_________________;
(3)有4.8gMg反应时时,外电路中转移电子数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com