
����Ŀ��X��Y��Z��W��R�Ƕ�����Ԫ�أ�ԭ�������������ǽ���Xԭ�Ӻ�����������֮��Ϊ1��2��Yԭ�Ӻ�Zԭ�ӵĺ��������֮��Ϊ20��W��R��ͬ��������Ԫ�أ�Y���������R������������γ����꣮��ش��������⣺
��1��Ԫ��X�����������ĵ���ʽΪ��Ԫ��Z�����ӽṹʾ��ͼΪ ��
��2������ͭ��Ԫ��Y������������Ӧˮ�����ϡ��Һ������Ӧ�Ļ�ѧ����ʽΪ ��
��3��Ԫ��Wλ�����ڱ��ĵ��壬��ǽ����Ա�R������ԭ�ӽṹ��֪ʶ����ԭ�� ��
��4��R��һ����������ʹƷ����Һ��ɫ����ҵ����Y����̬�⻯���ˮ��Һ��������������ռ���д�����ռ��������������ﷴӦ�����ӷ���ʽ�� ��
��5��Y��Z��ɵĻ�����ZY�������������������Ԫ������ҵ����Z�������X���ʺ�Y�����ڸ������Ʊ�ZY������Z���������X���ʵ����ʵ���֮��Ϊ1��3����÷�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��![]() ��
��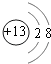
��2��8HNO3��ϡ��+3Cu�T2NO��+3Cu��NO3��2+4H2O
��3���������ڵ�VA�壻Pԭ�Ӻ�Sԭ�ӵĵ��Ӳ�����ͬ��Pԭ�Ӱ뾶�ϴõ�����������
��4��SO2+NH3?H2O�THSO ![]() +NH
+NH ![]()
��5��Al2O3+3C+N2 ![]() 2AlN+3CO
2AlN+3CO
���������⣺X��Y��Z��W��R�Ƕ�����Ԫ�أ�ԭ��������������Y���������R������������γ����꣬��YΪNԪ�ء�RΪSԪ�أ�W��R��ͬ��������Ԫ�أ���WΪPԪ�أ�Yԭ�Ӻ�Zԭ�ӵĺ��������֮��Ϊ20����Zԭ�Ӻ��������=20��7=13����ZΪAl���ǽ���Xԭ�Ӻ�����������֮��Ϊ1��2��X��2�����Ӳ㣬XΪCԪ�أ���1��Ԫ��X�����������ΪCO2 �� ������Cԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ�����ʽΪ ![]() ��Ԫ��Z������ΪAl3+ �� ���Ӻ��������Ϊ10�����������Ϊ2��8�����ӽṹʾ��ͼΪ
��Ԫ��Z������ΪAl3+ �� ���Ӻ��������Ϊ10�����������Ϊ2��8�����ӽṹʾ��ͼΪ 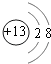 �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� 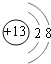 ����2������ͭ��ϡ���ᷴӦ��������ͭ��NO��ˮ����Ӧ����ʽΪ��8HNO3��ϡ��+3Cu�T2NO��+3Cu��NO3��2+4H2O�����Դ��ǣ�8HNO3��ϡ��+3Cu�T2NO��+3Cu��NO3��2+4H2O����3��Ԫ��WΪP��������3�����Ӳ㣬����������Ϊ5��λ�����ڱ��ĵ������ڵ�VA�壻Pԭ�Ӻ�Sԭ�ӵĵ��Ӳ�����ͬ��Pԭ�Ӱ뾶�ϴõ���������������P�ķǽ����Ա�Ԫ��S�������Դ��ǣ��������ڵ�VA�壻Pԭ�Ӻ�Sԭ�ӵĵ��Ӳ�����ͬ��Pԭ�Ӱ뾶�ϴõ���������������4��R��һ����������ʹƷ����Һ��ɫ����������ΪSO2 �� ��ҵ���ð���ˮ��Һ��������������ռ������ռ��������������ﷴӦ�����ӷ���ʽ��SO2+NH3H2O�THSO
����2������ͭ��ϡ���ᷴӦ��������ͭ��NO��ˮ����Ӧ����ʽΪ��8HNO3��ϡ��+3Cu�T2NO��+3Cu��NO3��2+4H2O�����Դ��ǣ�8HNO3��ϡ��+3Cu�T2NO��+3Cu��NO3��2+4H2O����3��Ԫ��WΪP��������3�����Ӳ㣬����������Ϊ5��λ�����ڱ��ĵ������ڵ�VA�壻Pԭ�Ӻ�Sԭ�ӵĵ��Ӳ�����ͬ��Pԭ�Ӱ뾶�ϴõ���������������P�ķǽ����Ա�Ԫ��S�������Դ��ǣ��������ڵ�VA�壻Pԭ�Ӻ�Sԭ�ӵĵ��Ӳ�����ͬ��Pԭ�Ӱ뾶�ϴõ���������������4��R��һ����������ʹƷ����Һ��ɫ����������ΪSO2 �� ��ҵ���ð���ˮ��Һ��������������ռ������ռ��������������ﷴӦ�����ӷ���ʽ��SO2+NH3H2O�THSO ![]() +NH
+NH ![]() �����Դ��ǣ�SO2+NH3H2O�THSO
�����Դ��ǣ�SO2+NH3H2O�THSO ![]() +NH
+NH ![]() ����5��N��Al��ɵĻ�����AlN�������������������Ԫ������ҵ������������̼�������ڸ������Ʊ���������������̼�����ʵ���֮��Ϊ1��3��˵��������CO����÷�Ӧ�Ļ�ѧ����ʽΪ��Al2O3+3C+N2
����5��N��Al��ɵĻ�����AlN�������������������Ԫ������ҵ������������̼�������ڸ������Ʊ���������������̼�����ʵ���֮��Ϊ1��3��˵��������CO����÷�Ӧ�Ļ�ѧ����ʽΪ��Al2O3+3C+N2 ![]() 2AlN+3CO�����Դ��ǣ�Al2O3+3C+N2
2AlN+3CO�����Դ��ǣ�Al2O3+3C+N2 ![]() 2AlN+3CO��
2AlN+3CO��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ʱ H2A === H+ + HA����HA��![]() H����A2��������˵����ȷ���ǣ� ��
H����A2��������˵����ȷ���ǣ� ��
A. ��ͬ���ʵ���Ũ�ȵ�H2A ��NaHA������Һ��c(HA��)�Ĵ�С��ϵ��ǰ��<����
B. ��ͬ���ʵ���Ũ�ȵ�H2A ��NaHA������Һ��c(A2��)�Ĵ�С��ϵ��ǰ��>����
C. Na2A ��Һ�д���c(Na��)��2c(A2��)��2c(HA��)
D. NaHA��Һ���������ԣ�Ҳ�����Լ��ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ��Ȼ���ʱ���������ַ��������ý���������ֱ�ӻ����Ƶã����ý��������ᷴӦ�Ƶá����������ַ����������Ƶõ��Ȼ�����( )
A. FeCl2 B. CuCl2 C. FeCl3 D. AlCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���õر�ʾ��Һ������ԣ���ѧ����������(AG)�ĸ��AG��lg[c(H+)/c(OH-)]��������������ȷ����(����)
A. ������Һ��AG��1 B. ������0.1 mol��L��1������Һ��AG��12
C. ������Һ��AG��0 D. ������0.1 mol��L��1 NaOH��Һ��AG��12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ��ʾ�������й�����Ũ�ȹ�ϵ�ıȽϣ���ȷ���� �� ��
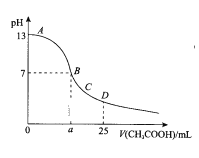
A. ��A��B����һ�㣬��Һ��һ������c(Na+)>c(CH3COO��)>c(OH��)>c(H+)
B. ��B�㣬a>12.5������c(Na+)��c(CH3COO��)=c(OH��)=c(H+)
C. ��C�㣺 c(Na+)> c(CH3COO��) > c(OH��)>c(H+)
D. ��D�㣺c(CH3COO��)+ c(CH3COOH)��2 c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ���ʽṹ�Ļ�ѧ������ȷ���ǣ� ��
A.8�����ӵ�̼ԭ�ӵĺ��ط��ţ�12C
B.HF�ĵ���ʽ�� ![]()
C.Cl�����ӵĽṹʾ��ͼ�� ![]()
D.CO2�Ľṹʽ��O=C=O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷����ɵ�ص�ͭñ(Zn��Cu�ܺ���ԼΪ99%)����ͭ���Ʊ�ZnO�IJ���ʵ��������£�
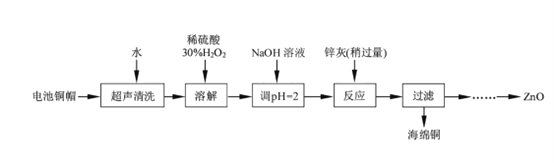
��1����ͭñ�ܽ�ʱ����H2O2��Ŀ����_______________���û�ѧ����ʽ��ʾ����
��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽����_________________��
��2��Ϊȷ������п������Ҫ�ɷ�ΪZn��ZnO������Ϊ��������������������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH=3��4���������KI����Na2S2O3����Һ�ζ����յ㡣���������е����ӷ���ʽ���£�2Cu2����4I��=2CuI(��ɫ)����I2��I2��2S2O32��=2I����S4O62��
�ٵζ�ѡ�õ�ָʾ��Ϊ________________���ζ��յ�۲쵽������Ϊ________________��
�����ζ�ǰ��Һ��H2O2û�г��������ⶨ��Cu2���ĺ�������______________������ƫ������ƫ����������������
��3����֪pH��11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2�����±��г��˼����������������������pH����ʼ������pH����������Ũ��Ϊ1.0 mol/L������
��ʼ������pH | ��ȫ������pH | |
Fe3�� | 1.1 | 3.2 |
Fe2�� | 5.8 | 8.8 |
Zn2�� | 5.9 | 8.9 |
ʵ���п�ѡ�õ��Լ���30% H2O2��1.0 mol��L��1HNO3��1.0 mol��L��1 NaOH��
�ɳ�ȥͭ����Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��������Һ�м���30%��H2O2ʹ���ַ�Ӧ��
�ڵμ�1.0 moL/L���������ƣ�����pHԼΪ_________________��ʹFe3��������ȫ��
�۹��ˣ�
������Һ�еμ�1.0 moL/L���������ƣ�����pHԼΪ________��ʹZn2��������ȫ��
��____________________________��
��900�����ա�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��Һ������ʹɳĮ�������¼�����������ɳĮ�еľ۱�ϩ����ˮ��Һ�еĸ߷�����ɳ�����ӽ�ϣ��ڵر���30��50cm�γɺ�0.5cm�ĸ�ˮ�㣬����ֹ���µ��η����������ء������ˮ���Ծ۱�ϩ������˵������ȷ����(����)
A.����Ľṹ��ʽΪCH2=CH��COOR
B.��һ���������ܷ����ӳɷ�Ӧ
C.��һ���������ܷ���ˮ�ⷴӦ
D.����ͨ������Ӿ۷�Ӧ�õ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˿���صĽṹ��ʽ��ͼ��ʾ�������й�����˵����ȷ���ǣ� �� 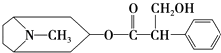
A.���ڷ�����
B.�����б����ϵ�һ�ȴ�����3��
C.����������Ʒ�����Ӧ
D.���ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com