
| A. | 向某溶液中滴加氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ | |
| B. | 钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 | |
| C. | 向某溶液中滴加氯化钡溶液,产生白色沉淀,再滴加足量稀硝酸,依然有白色固体,说明原溶液含有SO42- | |
| D. | 向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
分析 A.不能排除Fe3+的干扰;
B.应透过蓝色钴玻璃;
C.可能生成AgCl沉淀;
D.淀粉遇碘变蓝色.
解答 解:A.先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe2+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe2+,故A错误;
B.检验钾离子,可透过蓝色钴玻璃,以滤去黄光,故B错误;
C.不能排除生成AgCl沉淀,检验硫酸根离子,应先加入盐酸,如无现象,再加入氯化钡观察是否生成沉淀,故C错误;
D.淀粉遇碘变蓝色,则向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2,故D正确.
故选D.
点评 本题考查了常见离子的检验方法,题目难度不大,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,该类试题需要注意的是进行离子检验时,要依据离子的特殊性质和特征反应进行判断


科目:高中化学 来源: 题型:填空题
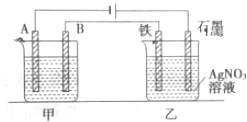
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
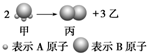 如图所示:已知甲、乙、丙常温下都为气体.
如图所示:已知甲、乙、丙常温下都为气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期 | B. | 第二周期 | C. | ⅤA族 | D. | ⅤⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的结构式为:O-C-O | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_{6}^{14}$C | |
| C. | 氯化镁的电子式: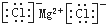 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 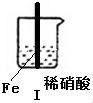 |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 | |
| D. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )| A. | 铁是阳极,电极反应为 Fe-6e-+4H2O=FeO42-+8H+ | |
| B. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| C. | 若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- | |
| D. | 电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成分是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com