
| A. | HCl | B. | H2SO4 | C. | 氨水 | D. | NaOH |
分析 根据题意,Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和强酸酸反应又能和强碱反应,要使明矾溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱,由此分析解答.
解答 解:A.盐酸不与氯化铝反应,故A不符合;
B.硫酸不与氯化铝反应,故B不符合;
C.氨水与氯化铝反应生成氢氧化铝沉淀,氨水是弱碱溶液,不能溶解Al(OH)3,可以全部沉淀Al3+,故C符合;
D.氢氧化铝是两性物质,与氢氧化钠反应,用氢氧化钠要控制氢氧化钠的量,故D不符合;
故选C.
点评 本题考查的是铝化合物的性质等,难度不大,重点考查氢氧化铝的实验室制备,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
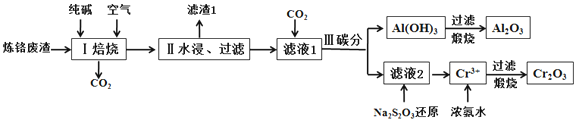
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
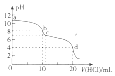 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | 该滴定过程应选择酚酞作指示剂 | |
| B. | a点时,溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| C. | b点时,溶液中存在:c(CO32-)+c(HCO3-)+c( H2CO3)=0.05 mol•L-1 | |
| D. | d点时,溶液中存在电离平衡:H2CO3?2 H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药、和炸药 | |
| B. | 石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 | |
| C. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 | |
| D. | SO2和氯水遇到紫色石蕊试液都先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
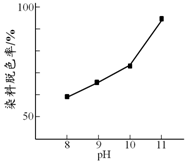 H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.| 初始pH | pH=10 | pH=12 |
| 1小时后H2O2溶液浓度 | 0.13mol•L-1 | 0.07mol•L-1 |
| 1小时后pH | 没有明显变化 | 没有明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com