
【题目】常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示。下列说法不正确的是

A. 曲线L1表示![]() 与pH的变化关系
与pH的变化关系
B. Ka(HA)=1×10-5.5
C. a点时两溶液中水的电离程度相同
D. 0.01mol·L-1MA溶液中存在:c(M+)>c(A-)>c(OH-)>c(H+)
【答案】C
【解析】
A.MCl溶液中加入NaOH溶液,溶液pH逐渐增大,M+离子逐渐减小,MOH的浓度逐渐增大,则lg![]() 的值逐渐减小,则曲线L1表示lg
的值逐渐减小,则曲线L1表示lg![]() 与pH的变化关系,故A正确;
与pH的变化关系,故A正确;
B.曲线L2表示lg![]() 与pH的关系,lg
与pH的关系,lg![]() =0时,
=0时,![]() =1,此时pH=5.5,c(H+)=1×10﹣5.5mol/L,则Ka(HA)=
=1,此时pH=5.5,c(H+)=1×10﹣5.5mol/L,则Ka(HA)=![]() =c(H+)=1×10﹣5.5,故B正确;
=c(H+)=1×10﹣5.5,故B正确;
C.a点溶液的pH>7,对于曲线L2,由于A﹣离子水解导致溶液呈碱性,促进了水的电离;而对于曲线L1,MCl溶液呈酸性,a点时呈碱性,说明MOH的电离程度大于M+离水解程度,抑制了水的电离,所以两溶液中水的电离程度不同,故C错误;
D.曲线L1中,lg![]() =0时,
=0时,![]() =1,Kb(MOH)=c(OH﹣)>1×10﹣5>1×10﹣5.5,根据Kh=
=1,Kb(MOH)=c(OH﹣)>1×10﹣5>1×10﹣5.5,根据Kh=![]() 可知,电离平衡常数越大,对应离子的水解程度越小,则水解程度A﹣>M+,则MA溶液呈碱性,则c(OH﹣)>c(H+)、c(M+)>c(A﹣),溶液中离子浓度大小为:c(M+)>c(A﹣)>c(OH﹣)>c(H+),故D正确;
可知,电离平衡常数越大,对应离子的水解程度越小,则水解程度A﹣>M+,则MA溶液呈碱性,则c(OH﹣)>c(H+)、c(M+)>c(A﹣),溶液中离子浓度大小为:c(M+)>c(A﹣)>c(OH﹣)>c(H+),故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】氮、磷是生物体中不可缺少的元素,它们能形成多种化合物。

(1)基态氮原子的价层电子排布图为___________。
(2)NF3的键角小于NH3的原因是__________________。
(3)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构。
①该化合物的分子式为______________,分子中硫原子的杂化轨道类型为____________________。
②磷的第一电离能大于硫的原因是________________________。
(4)PCl5中P—Cl键长有198pm和206 pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,阴离子的化学式为_________________。
(5)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
(6)某直链多磷酸钠的阴离子呈如图3所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下进行反应:2A(s)+B(g)![]() 3C(g)+4D(g),分别测得了如下反应速率数据,其中反应速率最快的是
3C(g)+4D(g),分别测得了如下反应速率数据,其中反应速率最快的是
A. v(A)=0.7 mol·L-1·s-1 B. v(B)=0.3 mol·L-1·s-1
C. v(C)=0.8 mol·L-1·s-1 D. v(D)=1.0 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,下图是利用手持技术得到的微粒物质的量变化图,常温下向20ml0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A = 2H+ + A2-
B. 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 当V(NaOH)=30mL时,则有:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D. 当V(NaOH)=40mL时,其溶液中水的电离受到抑制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g) ![]() pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )

A. T1<T2,P1>P2,m+n>p,△H>0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1>T2,P1<P2,m+n<p,△H<0
D. T1>T2,P1>P2,m+n>p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ②mg该硫原子的物质的量为
②mg该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNA g ④ag该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:

①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
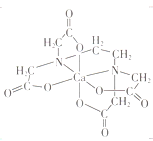
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com