
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3 (胶体)+3 H+ 明矾净水 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•x H2O+4HCl 用TiCl4制备TiO2 | |
| D. | SnCl2+H2O?Sn(OH)Cl+HCl 配制氯化亚锡溶液时应加入氢氧化钠 |
分析 A、盐的水解过程是吸热的过程,升高温度,可以促进盐的水解;
B、铝离子水解生成的氢氧化铝胶体具有净水的作用;
C、TiCl4水解可以得到TiO2•x H2O,加热失去结晶水即可得到二氧化钛;
D、SnCl2溶液水解显示酸性,可以加盐酸来抑制其水解.
解答 解:A、热的纯碱溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,水解过程是吸热的过程,升高温度,可以促进盐的水解,所以热的纯碱溶液清洗油污,属于盐的水解原理的应用,故A不选;
B、铝离子水解生成的氢氧化铝胶体:Al3++3H2O?Al(OH)3 (胶体)+3 H+,氢氧化铝胶体具有净水的作用,属于盐的水解原理的应用,故B不选;
C、TiCl4水解可以得到TiO2•x H2O,加热失去结晶水即可得到二氧化钛,据此可以用用TiCl4制备TiO2,故C不选;
D、SnCl2溶液水解显示酸性,可以加盐酸来抑制其水解,配制氯化亚锡溶液时加入氢氧化钠会促使平衡正向移动,不能制得氯化亚锡溶液,不属于盐的水解原理的应用,故D选.
故选D.
点评 本题考查学生盐的水解原理以及应用等方面的知识,属于综合知识的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{77}^{192}$Ir原子核内含有192个质子 | |
| B. | ${\;}_{77}^{192}$Ir 和${\;}_{77}^{191}$Ir互为同位素 | |
| C. | ${\;}_{77}^{192}$Ir原子核内含有77个中子 | |
| D. | ${\;}_{77}^{192}$Ir的电子数为115 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98g | |
| B. | 铁原子的摩尔质量等于铁的相对原子质量 | |
| C. | 标准状况下,22.4L的O2质量是32g | |
| D. | 2gH2所含原子物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
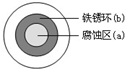
| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-→Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
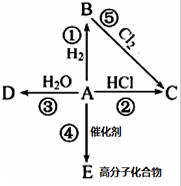 烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: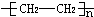 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是清洁能源,也是重要的化工原料.
氢气是清洁能源,也是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和稀硫酸 | B. | Fe和FeCl3溶液 | C. | FeO和稀硫酸 | D. | Fe2O3和稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com