
| A.H2CO3=2H++CO32- | B.Ba(OH)2=Ba2++2OH- |
| C.NaHSO4=Na++H++SO42- | D.HClO=H++ClO- |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:单选题
| A.不变 | B.增大 | C.减小 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
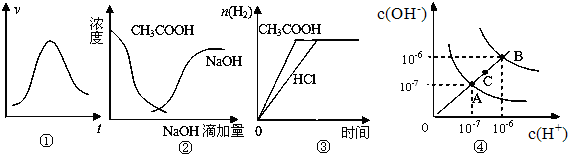
| A.图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应 |
| B.图②曲线表示将氢氧化钠溶液滴加到醋酸溶液中,反应物浓度的变化趋势图 |
| C.图③表示等体积、等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁粉,产生H2的物质的量的变化 |
| D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KClO3→K++Cl-+3O2- |
| B.NaHCO3→Na++H++CO32- |
| C.HS-+H2O?H3O++S2- |
| D.CH3COONH4?NH4++CH3COO- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2SO4═2Na++SO4-2 | B.Al2(SO4)3═2Al3++3SO42- |
| C.Ba(OH)2═Ba2++(OH-)2 | D.CuSO4═Cu2++S6++4O2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaHSO3与Na2SO3混合溶液中:3c(Na+) = c(HSO3-) + c(SO32-) |
| B.0.1mol·L-1的醋酸钠溶液20 mL与0.1mol·L-1盐酸10 mL混合后溶液显酸性 c (CH3COO-)>c (Cl-)>c (CH3COOH)>c (H+) |
| C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合: c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D.向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入0.2molCO2气体,溶液中: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com