
| A. | 5s | B. | 2p | C. | 3d | D. | 4s |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | WO3和WO2.9是同分异构体 | |
| B. | 由WO3制备WO2.9的过程发生了氧化还原反应 | |
| C. | 18g H2O在WO2.9的高效催化下产生H2体积为22.4L | |
| D. | 利用这种新型催化剂分解水的同时可放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molCO的质量为28 g | |
| B. | 铁原子的摩尔质量就是铁的相对原子质量 | |
| C. | 标准状况下,任何物质的摩尔体积都约是22.4 L | |
| D. | 1.42 gNa2SO4固体溶于100 mL水中,配得0.10 mol/L的硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KOH溶液可以将NH4Cl、NaBr、CuSO4、FeCl3区别开 | |
| B. | C、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| C. | 某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32? | |
| D. | 某溶液中先滴加氯水,再滴加KSCN溶液后显红色,则此溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
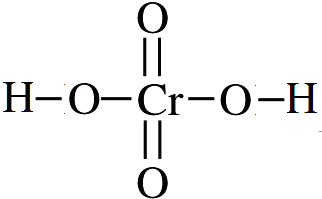 .
.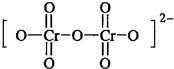
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com