

分析 (1)向V1mL0.1mol/L氨水中逐滴加入V2mL0.1mol/L盐酸生成氯化铵,因为氯化铵是强酸弱碱盐,其溶液呈酸性,所以当溶液PH=7时,氨水要过量一些;
当V1:V2=2:1时,反应后溶液为等量的氯化铵和氨水,溶液显碱性,再结合电荷守恒判断铵根离子和氯离子浓度大小;
(2)①根据该反应为放热反应,则升高反应体系的温度,平衡逆向移动,所以该反应的平衡常数K减小;
②应用三段式,平衡时NO的体积分数=$\frac{n(NO)}{n(总)}$进行计算;
(3)根据电解图,右边氮气得电子生成氨气,所以为阴极,则B为负极,A为正极,所以左边为阳极发生氧化反应,据此分析计算;
解答 解:(1)向V1mL0.1mol/L氨水中逐滴加入V2mL0.1mol/L盐酸生成氯化铵,因为氯化铵是强酸弱碱盐,其溶液呈酸性,所以当溶液PH=7时,氨水要过量一些,所以消耗氢氧化钠体积V1>V2;
当V1:V2=2:1时,反应后溶液为等量的氯化铵和氨水,溶液显碱性,c(OH-)>c(H+),再结合电荷守恒得c(NH4+)>C(Cl-),所以溶液中离子浓度大小顺序是cc(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:>;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(2)①因为该反应为放热反应,则升高反应体系的温度,平衡逆向移动,所以该反应的平衡常数K减小,故答案为:减小;
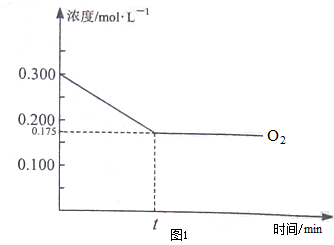
②由图象可知,氧气开始时浓度为0.3mol/L,平衡时为0.175moL/L,则
4NH3(g)+5O2(g)$?_{450℃}^{Pa-Rb}$4NO(g)+6H2O(g),
开始 0.15 0.3 0 0
反应 0.1 0.125 0.1 0.15
转化0.05 0.175 0.1 0.15
所以平衡时NO的体积分数=$\frac{n(NO)}{n(总)}$=$\frac{0.1}{0.1+0.175+0.05+0.15}$=21.05%,故答案为:21.05%;
(3)①根据电解图,右边氮气得电子生成氨气,所以为阴极,则B为负极,A为正极,故答案为:A;
②根据电解图,右边氮气得电子生成氨气,所以为阴极,反应式为:N2+6e-+6H+═2NH3,故答案为:N2+6e-+6H+═2NH3;
③根据电解图,右边氮气得电子生成氨气,所以为阴极,反应式为:N2+6e-+6H+═2NH3,左边为阳极发生氧化反应,反应式为4OH--4e-═O2+2H2O,又阳极生成aL氧气则转移$\frac{a}{22.4}$×4mol=$\frac{a}{5.6}$mol电子,根据得失电子守恒则阴极生成氨气为$\frac{\frac{a}{5.6}}{6}$×2=$\frac{a}{16.8}$mol,所以剩余N2的体积为b-$\frac{a}{16.8}$×22.4=b-$\frac{4}{3}$a;反应消耗的氮气为$\frac{a}{16.8}$×$\frac{1}{2}$×22.4=$\frac{2}{3}$a,则N2的转化率为$\frac{\frac{2}{3}a}{\frac{2}{3}a+b-\frac{4}{3}a}$×100%=$\frac{2a}{3b-2a}$×100%;故答案为:$\frac{2a}{3b-2a}$×100%;
点评 本题考查了溶液中离子浓度的比较,化学平衡的判断与计算以及电解原理的分析应用,电子转移计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列关于同系物的说法中,错误的是( )
A.同系物具有相同的最简式
B.同系物能符合同一通式
C.同系物中,相邻的同系物彼此在组成上相差一个CH2原子团
D.同系物的化学性质基本相似,物理性质随碳原子数增加而呈规律性变化
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:计算题
综合题:
氢气是清洁的能源,也是重要的化工原料,根据以下三种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见下图,图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
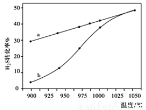
①△H0,(“>”、“<”或“=”)。
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=
(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=kJ/mol;
CaCO3(s)+2H2(g)的△H=kJ/mol;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(3)方法三:利用甲醇可以与水蒸气反 应制取H2,反应方程式如下:
应制取H2,反应方程式如下:
CH3OH(g)+H2O(g) CO2(g)+3H2(g)△H=+49.4kJ/mol
CO2(g)+3H2(g)△H=+49.4kJ/mol
一定温度下,向容积为2L的密闭恒容容器中充入1molCH3OH(g)和3molH2O(g),达到平衡状态时,吸收热量19.76kJ。则
①达平衡时混合气体的压强是反应前的倍。
②此温度下的该反应的平衡常数是(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA
B.1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA
C.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
D.标况下,11.2LSO3所含的分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=_________kJ·mol-1
(2)工业上极少用方法I制取Cu2O是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:________________。
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_________________________。
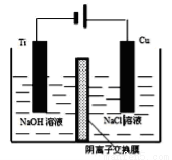
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:写出电极反应式并说明该装置制备Cu2O的原理___________________。
(5)在相同的密闭容器中.用以上两种方法制得的Cu2O分别进行催化分解水的实验:
 △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:

下列叙述正确的是_________(填字母)。
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率v(O2)=7×10-5mol·L-1·min-1
C.实验②比实验①所用的Cu2O催化效率高
D.实脸①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:
很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com