
【题目】A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为(用元素符号表示).
②M是含有键的分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为 , W分子的空间构型为 .
⑤AB﹣离子中和B2分子的π键数目比为 .
【答案】N>O>C;极性;非极性;氨分子间存在氢键,分子间作用力大,因而易液化;正四面体;V形;1:1
【解析】解:A、B、C、D是周期表中前10号元素,它们的原子半径依次减小;D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化,则D是H元素、A是C、B是N、C是O元素,M、N、W分别是CH4、NH3、H2O,①同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第IVA族元素第一电离能大于其相邻元素,N元素位于第VA族,所以A、B、C第一电离能大小顺序是N>O>C,所以答案是:N>O>C;②M是CH4 , 为正四面体结构,甲烷分子中C﹣H原子之间存在极性键,甲烷分子正负电荷重心重合,为非极性分子,所以答案是:极性;非极性;③N为NH3 , 因为氨分子间存在氢键,分子间作用力大,因而易液化,
所以答案是:氨分子间存在氢键,分子间作用力大,因而易液化;④W是H2O,H2O分子中O原子价层电子对个数是4且含2个孤电子对,根据价层电子对互斥理论判断其VSEPR模型为正四面体结构、空间构型为V形,所以答案是:正四面体;V形;⑤CN﹣离子与N2互为等电子体,二者结构相似,故其电子式为 ![]() ,AB﹣离子中和B2分子的π键数目比=2:2=1:1,所以答案是:1:1.
,AB﹣离子中和B2分子的π键数目比=2:2=1:1,所以答案是:1:1.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】用下列各组仪器或装置,不能达到实验目的是( ) 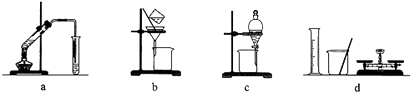
A.a组:制备少量乙酸乙酯
B.b组:除去粗盐水中的泥沙
C.c组:用CCl4提取碘水中的碘
D.d组:配制100 mL 1.00 mol/L NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应原理与化学反应方程式相符的是( )
A.过量的铁粉在氯气中燃烧:Fe+Cl2 ![]() FeCl2
FeCl2
B.金属钠在空气中燃烧:4Na+O2 ![]() 2Na2O
2Na2O
C.高炉炼铁中,还原铁矿石:2Fe2O3+3C ![]() 4Fe+3CO2
4Fe+3CO2
D.金属镁着火,不能用CO2灭火:2Mg+CO2 ![]() 2MgO+C
2MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)S2﹣中含有18个电子,画出S的原子结构示意图 .
(2)一水合氨(NH3H2O)是一种弱电解质,在水中可电离出铵根离子和氢氧根离子,试写出一水合氨的电离方程式 .
(3)正长石的组成可表示为KAlSi3Ox , 试根据化合价计算x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 , 向其中加入少量KOH溶液时,发生反应的离子方程式是;
(2)现将0.04molL﹣1HA溶液和0.02molL﹣1NaOH溶液等体积混合,得到缓冲溶液.
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)c(CN﹣)(填“<”、“=”或“>”),你得出该结论的依据是;该混合溶液的质子守恒式是 .
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是 . 该混合溶液的物料守恒式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO47H2O),实验操作过程如下: 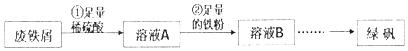
已知:杂质不溶于稀硫酸.
请回答下列问题:
(1)步骤①中,稀硫酸与Fe2O3反应的方程式为 , 废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 .
(2)步骤②中溶液A与铁粉反应的离子方程式为 .
(3)检验溶液B中是否还存在Fe3+的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2molL﹣1稀硫酸,微热使样品溶解.再加入30mL水加热,用0.2000molL﹣1 KMnO4溶液滴定至终点,消耗8.00mLKMnO4溶液.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500molL﹣1 Na2S2O3标准溶液滴定至终点,消耗8.00mLNa2S2O3溶液.
已知涉及的部分反应的离子方程式为:
步骤a:2MnO4﹣+5C2O42﹣+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I﹣=2CuI↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
(1)已知室温下CuI的Ksp=1.27×10﹣12 , 欲使溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , 应保持溶液中c(I﹣)≥molL﹣1 .
(2)MnO4﹣在酸性条件下,加热能分解为O2 , 同时生成Mn2+ .
写出该反应的离子方程式为 .
若无此加热操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”).
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 .
(4)通过计算确定样品晶体的组成.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧是同周期相邻的三种元素,碳、氮、氧及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
(1)碳、氮、氧的第一电离能由大到小顺序为
(2)H2O的中心原子杂化轨道空间构型为 , 固态H2O的晶体类型为 ,
(3)比较键角的大小:H2OCH4(填“>”“<”或“=”),原因为
(4)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com