
| A. | 混合物--液氯、漂白粉 | B. | 碱性氧化物--Al2O3、Na2O2 | ||
| C. | 强电解质--NH4Cl、HClO | D. | 非电解质--NH3、SO2 |
分析 只有一种物质组成的是纯净物;由两种或两种以上物质组成的是混合物;电解质是在水溶液中或熔融状态下能导电的化合物;非电解质是在水溶液中和熔融状态下均不能导电的化合物;强电解质是在水溶液或熔融状态下完全电离出离子的化合物;碱性氧化物是指能与酸反应生成盐和水的化合物.据此分析.
解答 解:A、液氯是液态的氯气,是纯净物,故A错误;
B、氧化铝既能与酸反应又能与碱反应生成盐和水,是两性氧化物,Na2O2能与酸反应生成盐、水,还有氧气,不是碱性氧化物,故B错误;
C、HClO在水溶液中部分电离,属于弱电解质,故C错误;
D、NH3溶于水后,能和水反应生成一水合氨,一水合氨能电离出自由移动的阴阳离子,但电离出阴阳离子的是一水合氨,不是NH3,所以NH3是非电解质;SO2为化合物,其水溶液能导电,但其本身不发生电离,则属于非电解质,故D正确.
故选D.
点评 本题考查了基本概念的含义和判断,主要考查碱性氧化物氧化物、非电解质、电解质、混合物等知识的分析判断,较简单.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ | |
| C. | FeSO4溶液中滴加双氧水:2Fe2++2H2O2═2Fe3++O2↑+2H2O | |
| D. | 向Ca(ClO)2溶液中通入足量SO2:ClO-+H2O+SO2═HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CHOHCH3 | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫酸 | 纯碱 | 石膏 | 碳酐 |
| B | 氢氯酸 | 烧碱 | 纯碱 | 生石灰 |
| C | 碳酸 | 明矾 | 胆矾 | 二氧化硫 |
| D | 二氧化碳 | 苛性钠 | 食盐 | 石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 混合体系 | 溴水 | 酒精与水 | 固体碘和氯化铵 | 混有少量KCl的KNO3粉末 |
| 分离方法 | 萃取、分液 | 加生石灰,蒸馏 | 加热 | 配成热的饱和溶液、降温结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CH3OH所含中子数为14NA | |
| B. | 常温常压下,1mol Na2CO3所含CO32-的数目等于NA | |
| C. | 56g Fe与足量水蒸气反应,转移的电子数目为$\frac{8}{3}$NA | |
| D. | 1L pH=0的H2SO4所含H+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性 | |
| D. | 三种分散系中分散质均属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
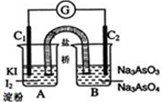 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com