
| A. | 催化剂 | B. | 浓度 | C. | 压强 | D. | 温度 |
分析 A.催化剂对平衡移动无影响;
B.对反应前后体积不变的反应,缩小体积,浓度均增大,但平衡不移动;
C.对反应前后体积不变的反应,增大压强,平衡不移动;
D.反应中一定为吸热或放热反应,升高温度平衡向吸热的方向移动.
解答 解:A.改变催化剂,平衡一定不发生移动,故A不选;
B.对反应前后体积不变的反应,缩小或增大体积改变浓度,平衡不移动,故B不选;
C.对反应前后体积不变的反应,改变压强,平衡不移动,故C不选;
D.反应一定伴随能量变化,则改变温度,平衡一定发生移动,故D选;
故选D.
点评 本题考查化学平衡移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意分析反应方程式的特点,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测氨水溶液的体积/mL | 0.10mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
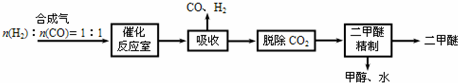
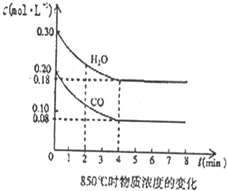
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a+b<c+d,增大压强,则平衡向左移动 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量小于(m+n)mol | |
| D. | 若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
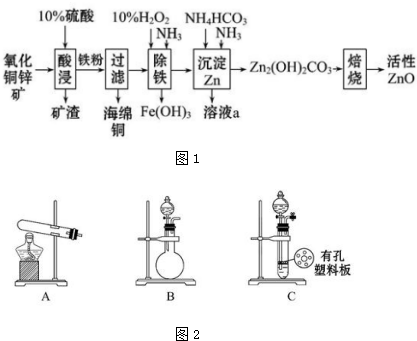
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com