
| A、增加NaOH | B、加热 |
| C、加水 | D、加浓盐酸 |


科目:高中化学 来源: 题型:
| A、平均反应速率:v(A)=v(C) |
| B、其它条件不变,升温,气体总的物质的量增加 |
| C、A的平衡浓度为0.4mol/L |
| D、A与B的平衡浓度之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2可用于呼吸面具中氧气的来源 |
| B、Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物 |
| C、Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治胃酸过多,制发酵粉等 |
| D、NaCl的性质稳定,可用作调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钡的化学式为Ba2O2 |
| B、晶体中阴阳离子个数比为2:1 |
| C、1mol过氧化钡与足量水反应生成0.5mol氧气 |
| D、过氧化钠和过氧化钡都是强氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN- |
| B、含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I- |
| C、在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、含有大量ClO-的溶液:OH-、K+、I-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
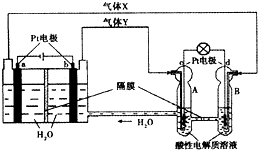 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A、当有0.2mol电子转移时,a极产生1.12L O2 |
| B、该装置开始工作后,右端装置能量变化为:电能→化学能 |
| C、d极上发生的电极反应是:O2+4H++4e一═2H2O |
| D、c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶质的物质的量浓度c=
| ||
B、溶质的质量分数为ω=
| ||
C、溶液中c(OH-)=
| ||
| D、上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O-→C6H5OH+HCO3- |
| D、用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-=Mn2++Cl2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com