
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷; 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基. 分析 (1)该有机物为烷烃,选取最长碳链为主链,然后从取代基编号之和最长的一端编号,先写出取代基位置,在写出主链名称;
(2)该有机物为炔烃,选取含有碳碳三键的最长碳链为主链,然后从距离碳碳三键最近的一端开始编号,命名中需要标出碳碳三键的位置;
(3)甲基连接的碳为1号C,在2、4号C各含有应该氯原子;
(4)根据图示的有机物结构简式写出分子式;根据该有机物结构判断具有的化学性质;
(5)根据结构简式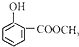 可知,该有机物分子中含有的官能团为羟基和酯基.
可知,该有机物分子中含有的官能团为羟基和酯基.
解答 解:(1)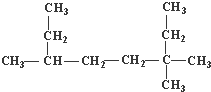 ,该有机物分子中最长碳链含有8个C,主链为辛烷,从右上方开始编号,在3号C含有2个甲基、在6号C含有1个甲基,该有机物名称为:3,3,6-三甲基辛烷,故答案为:3,3,6-三甲基辛烷;
,该有机物分子中最长碳链含有8个C,主链为辛烷,从右上方开始编号,在3号C含有2个甲基、在6号C含有1个甲基,该有机物名称为:3,3,6-三甲基辛烷,故答案为:3,3,6-三甲基辛烷;
(2) ,该有机物为炔烃,选取含有碳碳三键的最长碳链为主链,该有机物最长碳链含有7个C,主链为庚炔,编号从右边开始,碳碳三键在1号C,在3、6号C各含有1个甲基,该有机物名称为:3,6-二甲基-1-庚炔,故答案为:3,6-二甲基-1-庚炔;
,该有机物为炔烃,选取含有碳碳三键的最长碳链为主链,该有机物最长碳链含有7个C,主链为庚炔,编号从右边开始,碳碳三键在1号C,在3、6号C各含有1个甲基,该有机物名称为:3,6-二甲基-1-庚炔,故答案为:3,6-二甲基-1-庚炔;
(3)2,4-二氯甲苯的主链为甲苯,甲苯所在的C为1号C,在2、4号C各含有一个氯原子,该有机物结构简式为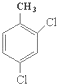 ,故答案为:
,故答案为: ;
;
(4)该有机物分子中含有15个C、22个H和2个O,该有机物的分子式为:C15H22O2;该有机物含有碳碳双键,能够与被酸性高锰酸钾溶液氧化,能够与氢气发生加成反应,能够使溴水褪色;分子中还含有羧基,能够与氢氧化钠溶液发生中和反应,所以ABCD都正确,故答案为:C15H22O2;ABCD;
(5)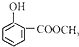 中含有的官能团为羟基、酯基,故答案为:羟基;酯基.
中含有的官能团为羟基、酯基,故答案为:羟基;酯基.
点评 本题考查了有机物结构与性质,题目难度中等,试题涉及的题量较大,知识点较多,充分考查了学生对所学知识的掌握情况,注意掌握常见有机物结构与性质,明确有机物命名原则,能够正确书写常见有机物的结构简式.


科目:高中化学 来源: 题型:解答题
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | Y的氢化物比Z的氢化物稳定 | |
| B. | 原子半径大小顺序是X>Y>R | |
| C. | Y、R形成的化台物YR3能使酸性KMnO4溶液褪色 | |
| D. | 四种元素中最高价氧化物的水化物的酸性最强的是Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 增大压强一定能使化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种 | B. | 四种 | C. | 五种 | D. | 六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Mg>O | |
| B. | 13C和14C属于同位素 | |
| C. | 0族元素是同周期中非金属性最强的元素 | |
| D. | N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com