
设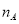 为阿伏加德罗常数的数值,下列说法正确的是
为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol CH5+所含电子数为8nA
B. 标准状况下,11.2L Br2中Br原子数为nA
C. 1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA
D.18 g的D216O中含有的中子数为9 NA
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述中,能证明某物质是强电解质或弱电解质的是
A.某物质熔化时不导电,则该物质为弱电解质
B.某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质
C.某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸
D.溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷乙(解析版) 题型:填空题
等体积的0.5 mol/L的三种溶液硫酸钠、硫酸镁、硫酸铝中,阳离子(金属离子)的个数比是 ;阴离子(SO42-)的个数比是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
Y | 最外层电子数是次外层的3倍 |
Z | 短周期中,其原子半径最大 |
Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
下列有关说法中正确的是( )
A.原子半径:X > Y > M
B. 由X、M和氢三种元素不可能形成离子化合物
C.气态氢化物热稳定性:M > Y > X
D.Z、Q、M的最高价氧化物对应的水化物可以两两发生反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高考预测理综化学试卷(解析版) 题型:选择题
下列实验操作能达到预期实验目的的是
| 实验目的 | 实验操作 |
A | 鉴别Al3+和Fe3+ | 分别加入过量NaOH溶液 |
B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高考预测理综化学试卷二(解析版) 题型:填空题
(本题16分)
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
T/℃ n/mol | NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) = 2NO(g) ; ΔH = + 180.5kJ/mol,
则氨催化氧化的热化学方程式为________________________________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
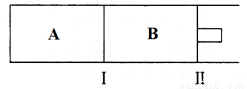
当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为___________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将___________(填“正向”、“逆向”或“不”)移动。
(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的两种Cu2O分别进行催化分解水的实验:
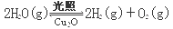 ΔH >0
ΔH >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(5)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极和乙醛-Na2SO4溶液为电解质溶液,乙醛分别在阴、阳极转化为乙醇和乙酸。
总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。
过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高考预测理综化学试卷二(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1L0.1mol·L-1的氨水中有NA个NH4+
B.常温常压下,8gO2含有4NA个电子
C.标准状况下,22.4L三氯甲烷含有NA个分子
D.1molNa被完全氧化生成Na2O2,失去2NA电子
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:填空题
(18分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
下列各组离子中,能大量共存且形成无色透明溶液的是
A.Mg2+、H+、C1-、OH- B.Na+、Ba2+、C1-、NO3-
C.Na+、H+、Cl-、CO32- D.K+、Cu2+、NO3-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com