
分析 (1)根据v=$\frac{△c}{△t}$计算反应速率;
(2)利用三段式法计算平衡浓度,根据平衡常数表达式计算;
(3)缩小容器体积,压强增大,正逆反应速率都增大,平衡正向移动;
(4)二氧化硫和氨水反应可生产亚硫酸铵或亚硫酸氢铵;
(5)①根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,2SO42-失电子变成S2O82-,电极反应式为:2SO42--2e-═S2O82-,
VO2+转变为VO2+,发生还原反应,应为电解池的阴极,VO2++2e-+2H+=VO2++H2O,若电解得1mol(NH4)2S2O8,则有2mol氢离子被消耗,故电解槽中氢离子浓度减小2mol;
②充电时,阳极失电子发生氧化反应:VO2++H2O-e-=VO2++2H+.
解答 解:经5min反应达平衡,SO2的平衡转化率(α)为80%,则
2SO2(g)+O2(g)?2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
(1)v(SO3)=$\frac{0.16mol/L}{5min}$=0.032mol/(L•min),
故答案为:0.032;
(2)K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{(0.16)^{2}}{(0.04)^{2}×0.02}$=800,
故答案为:800;
(3)缩小容器体积,压强增大,正逆反应速率都增大,平衡正向移动,图象为: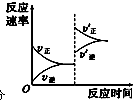 ;故答案为:
;故答案为: ;
;
(4)少量的二氧化硫和氨水反应生成亚硫酸铵,足量二氧化硫和氨水反应生产亚硫酸氢铵,
反应离子方程式为:2NH3•H2O+SO2=2NH4++SO32- 或NH3•H2O+SO2=NH4++HSO3-;
故答案为:2NH3•H2O+SO2=2NH4++SO32- 或NH3•H2O+SO2=NH4++HSO3-;
(5)①根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,2SO42-失电子变成S2O82-,电极反应式为:2SO42--2e-═S2O82-,
VO2+转变为VO2+,发生还原反应,应为电解池的阴极,VO2++2e-+2H+=VO2++H2O,若电解得1mol(NH4)2S2O8,则有2mol氢离子被消耗,
故电解槽中氢离子浓度减小2mol;
故故答案为:2SO42--2e-═S2O82-;减小;2;
②充电过程中,阳极失电子发生还原反应,电极反应式为VO2++H2O-e-═VO2++2H+,
故答案为:VO2++H2O-e-═VO2++2H+;
点评 本题考查了速率的计算和平衡常数的计算影响平衡的因素及电化学知识,中等难度.注意根据题给信息书写电极反应式.


科目:高中化学 来源: 题型:选择题
| A. | 若X、Y位于 IA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第3周期,则X、Y形成的化合物可能是离子化合物或共价化合物 | |
| C. | 若气态氢化物的沸点:X>Y,则X、Y只能位于周期表 VIIA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中的HCl | |
| B. | 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 验证碳酸的酸性强于硅酸 | |
| D. | 分离苯和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.
图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Ba2+、NO3-、Cl- | B. | K+、Na+、OH-、NO3- | ||
| C. | H+、Ag+、Cl-、SO42- | D. | Cu2+、Ca2+、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com