
(22分) A B C D E是前四周期元素,且原子序数依次增大。A的原子核中只有一个质子;B原子外围电子排布nS n nP n ;D原子核外有2个电子层,S轨道电子总数和P轨道电子总数相等 ;E 2+ 的M能层上各能级的电子数之比为1:3:3 请回答下列问题:
(1)E原子基态电子排布式
(2)这五种元素中电负性最大的是 (填元素符号,下同)第一电离能最小的是
(3)化合物EBC2中阴离子是BC22-,和BC2 2- 互为等电子体的分子有C2D和 ,由此可知BC2 2- 的空间构型是 。
(4)由A C两元素形成一种10电子分子X,写出X的电子式
X可与多种金属离子形成配合物。钴有两种化学式均为Co(X)5BrSO4的配合物,且配位数均为6,则它们分别溶于水时电离出的阳离子的化学式可能是 和 ;
(5)A C两元素还能形成一种离子化合物,写出该化合物化学式 ;你认为该化合物中除了离子键外还存在化学键是 ;该化合物溶于水有气体产生,写出反应化学方程式
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
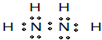
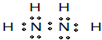
| 电子能I(Ev) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器编号 | a | b | c | d | e |
| 名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
| 改正的名称 | 无 无 |
容量瓶 容量瓶 |
无 无 |
酸式滴定管 酸式滴定管 |
无 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |
| A | ↓ | - | ↓ | - | |
| B | ↓ | ↓ | - | ||
| C | - | ↓ | ↑ | - | |
| D | ↓ | ↓ | ↑ | ↓ | |
| E | - | - | - | ↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com