“氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。
A. 2H
2(g)+O
2(g)=2H
2O(l) △H=-142.9kJ/mol
B. H
2(g)+1/2O
2(g)=H
2O(l) △H=-285.8kJ/mol
C. 2H
2+O
2=2H
2O(l) △H=-571.6 kJ/mol
D. H
2(g)+1/2O
2(g)=H
2O(g) △H=-285.8 kJ/mol
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H
2的反应步骤:
①CaBr
2+H
2O

CaO+2HBr
②2HBr+Hg

HgBr
2+H
2 ③HgBr
2+_____

______
④2HgO
2
Hg+O
2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:__________________。根据“绿色化学”的思想评估该方法制H
2的主要缺点:_______。
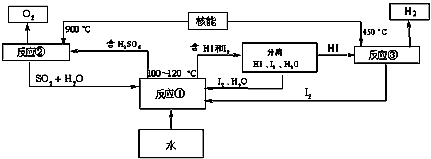
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O
2、SO
2和H
2O) 完成下列反应的化学方程式:
反应①_______________;反应②_____________。此法制取氢气的最大优点是__________________
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H
2O(g)

CO
2(g)+H
2(g) △H<0 在850℃时,
K=1。
(1)若升高温度到950℃时,达到平衡时K_____(填“大于”“小于”或“等 于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H
2O、 1.0 molCO
2和xmol H
2,则 ①当x=5.0时,上述平衡向_____(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H
2的体积分数分别为a%、b%,则a_____(填“大于”“小 于”或“等于”)b。
V.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu
2O 在酸性溶液中可发生自身氧化还原反应,生成Cu
2+和单质铜。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8 g,其中含单质铜与氧化亚铜的物质的量之比是_____;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体_______g;
(3)若将6 8 g上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1. 568 L的气体(不考虑NO
2的溶解,也不考虑NO
2与N
2O
4的转化),则该气体的成分
是_______,其物质的量之比是_______;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤出来,得晶体23. 68 g。经分析,原溶液中的Cu
2+有
20%残留在母液中。求所得晶体的化学式:_______。

 CaO+2HBr
CaO+2HBr HgBr2+H2
HgBr2+H2  ______
______  Hg+O2↑
Hg+O2↑ 
 CO2(g)+H2(g) △H<0 在850℃时,
CO2(g)+H2(g) △H<0 在850℃时, CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2  HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑