
【题目】一定条件下,0.3molN2(g)与0.3molH2(g)在体积为1L的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列示意图合理的是( )
2NH3(g),下列示意图合理的是( )
A.  B.
B. 
C.  D.
D. 
【答案】C
【解析】
A、因为为可逆反应,消耗H2物质的量应小于0.3mol,则消耗N2物质的量小于0.1mol,则平衡时N2物质的量大于0.2mol,图象不符合,选项A不符合;
B、反应速率之比等于化学方程式计量数之比,2υ(N2)正=υ(NH3)逆,此时反应达到平衡状态,υ(N2)正=υ(NH3)逆时,反应没有达到平衡状态,选项B不符合;
C、设转化N2物质的量为x,随反应进行N2、H2、NH3物质的量依次为(0.3-x)mol、(0.3-3x)mol、2xmol,N2的体积分数为![]() ×100%=50%,随反应进行N2的体积分数分数不变化恒为50%,NH3的体积分数逐渐增大,但小于50%,图象符合,选项C符合;
×100%=50%,随反应进行N2的体积分数分数不变化恒为50%,NH3的体积分数逐渐增大,但小于50%,图象符合,选项C符合;
D、H2消耗0.1mol,生成NH3物质的量为![]() mol,图象中反应的定量关系不符合反应比,选项D不符合;
mol,图象中反应的定量关系不符合反应比,选项D不符合;
答案选C。


科目:高中化学 来源: 题型:
【题目】现榨的苹果汁在空气中会由浅绿色变为棕黄色,你猜测可能的原因是
A.苹果汁中含有Cu2+B.苹果汁中含有OH﹣
C.苹果汁中含有Na+D.苹果汁中的Fe2+变成Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为可逆反应A(s)+3B(g) ![]() 2C(g)+2D(g)在不同条件下的化学反应速率,其中表示速率最快的是( )
2C(g)+2D(g)在不同条件下的化学反应速率,其中表示速率最快的是( )
A. υ(A)=0.5mol·L-1·min-1B. υ(B)=0.020mol·L-1·s-1
C. υ(C)=0.4mol·L-1·min-1D. υ(D)=0.015mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中加入一定量的A(s)和B(g),进行如下可逆反应:A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
A. ①⑤B. ③⑤C. ②④D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是

A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。

(2)下图表示的总反应的化学方程式为______________________。
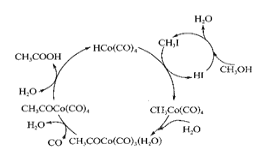
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有![]() 键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
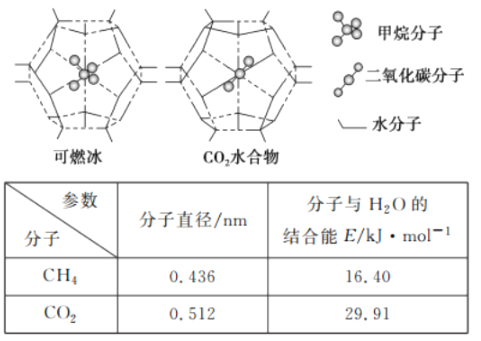
(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHC03与Na2C03的性质,下列叙述中不正确的是
A. Na2C03和NaHC03粉末与同浓度盐酸反应时,Na2C03因碱性强,所以与盐酸反应放出气体速度快
B. 等物质的量的两种盐与同浓度盐酸反应,Na2C03所消耗盐酸的体积是 NaHC03的两倍
C. 向Na2C03饱和溶液中通人过量CO2,有NaHC03结晶析出
D. Na2C03和NaHC03溶液分别和BaCl2溶液反应,现象不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com