
【题目】(1)已知单质硫16 g燃烧放热为149 kJ,写出硫燃烧热的热化学方程式:_________________
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知: C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:_____________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497 kJ/mol。 N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,NO分子中化学键的键能为_____ kJ/mol。
(4)S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol;
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol;
③S(单斜,s)=S(正交,s) ΔH3=_____。
S(单斜,s)比S(正交,s)更_________(填“稳定”或“不稳定”)
(5)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1 、ΔH2,则ΔH1___________ΔH2。(用“>”、“<”或“=”填空)
(6)相同条件下,2 mol氢原子所具有的能量________1 mol 氢分子所具有的能量。(用“>”、“<”或“=”填空)
【答案】S(g)+O2(g)=SO2(g) △H=-298 kJ/mol △H=+226.7 kJ/mol 631.5 kJ/mol -0.33 kJ/mol 不稳定 = >
【解析】
(1)先根据n=![]() 计算16 g S的物质的量,然后结合燃烧热的概念书写表示物质燃烧热的热化学方程式;
计算16 g S的物质的量,然后结合燃烧热的概念书写表示物质燃烧热的热化学方程式;
(2)将已知的热化学方程式叠加,可得待求反应的热化学方程式;
(3)根据反应热等于反应物总键能与生成物总键能的差计算NO分子中化学键的键能;
(4)根据盖斯定律,将已知热化学方程式叠加,可得单斜硫与正交硫转化的热化学方程式然后进行判断;依据物质含有的能量越低,物质的稳定性越强分析判断;
(5)根据盖斯定律分析比较;
(6)根据断裂化学键吸收能量,形成化学键释放能量分析比较。
(1)16 g S的物质的量n(S)=![]() =0.5 mol,0.5 mol S完全燃烧产生SO2气体放出热量149 kJ,则1 mol S完全燃烧产生SO2气体放出热量Q=2×149 kJ=298 kJ,故S燃烧热的热化学方程式为S(g)+O2(g)=SO2(g),△H=-298 kJ/mol;
=0.5 mol,0.5 mol S完全燃烧产生SO2气体放出热量149 kJ,则1 mol S完全燃烧产生SO2气体放出热量Q=2×149 kJ=298 kJ,故S燃烧热的热化学方程式为S(g)+O2(g)=SO2(g),△H=-298 kJ/mol;
(2)①C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,①×4+②-③,整理可得4C(石墨,s)+2H2(g)=2C2H2(g) ΔH3=+453.4 kJ/mol,所以2C(石墨,s)+H2(g)=C2H2(g) ΔH3=+226.7 kJ/mol;
(3)根据反应热等于反应物总键能与生成物总键能的差,假设NO中键能为x,可知946 kJ/mol+497 kJ/mol-2×x=+180.0 kJ/mol,解得x=631.5 kJ/mol;
(4)①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol;
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol;
根据盖斯定律,将①-②,整理可得S(单斜,s)= S(正交,s) ΔH=ΔH1-ΔH2=-0.33 kJ/mol;
根据该热化学方程式可知:单斜硫转化为正交硫放出热量,说明正交硫能量比单斜硫的能量低,物质含有的能量越低,物质的稳定性就越强,故单斜硫不如正交硫的稳定性强;
(5)反应热只与反应的温度、物质的状态有关,而与反应条件无关,所以同温同压下,在光照和点燃条件下的H2(g)+Cl2(g)=2HCl(g)ΔH(化学计量数相同)分别为ΔH1 、ΔH2,则ΔH1=ΔH2;
(6)由于键能是形成1 mol化学键所释放的能量或断裂1 mol化学键所吸收的能量,说明含有化学键的分子所具有的能量比形成该化学键的原子的能量低,因此在相同条件下,2 mol氢原子所具有的能量比1 mol氢分子所具有的能量高。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如右图所示。
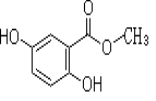
回答以下问题:
(1)龙胆酸甲酯所含官能团名称为 _________________
(2)龙胆酸甲酯的分子式为________________
(3)下列有关龙胆酸甲酯的描述,正确的是______________(填字母)。
a.能发生消去反应
b.能与氢气发生加成反应
c.能与浓溴水反应
(4)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式___________________ 。
(5)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_________、____________。
① 能发生银镜反应; ② 能使FeCl3溶液显色;
③ 酯类 ④苯环上的一氯代物只有两种
(6)已知X及其它几种有机物存在如下转化关系,且测得C4H8含有一个支链,A的核磁共振氢谱图中有两个吸收峰。
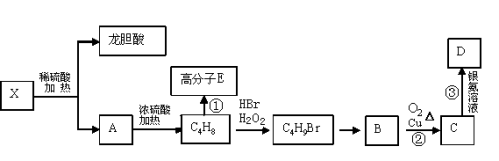
写出①的化学方程式____________________________________。
②的化学方程式______________________________________。
③化学方程式 ________________________________________。
写出X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列油脂的性质和用途与其含有的碳碳双键(![]() )有关的是( )
)有关的是( )
A.适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素
B.利用油脂在碱性条件下的水解可以生产甘油和肥皂
C.植物油通过氢化可以制造植物奶油(人造奶油)
D.脂肪是人体中储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是
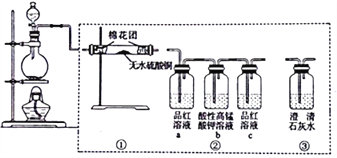
A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂以甘蔗为原料制糖,对产生的大量甘蔗渣按如图所示转化进行综合利用(部分反应条件及产物没有列出)。
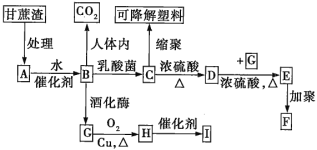
其中B是A水解的最终产物;C的分子式为C3H6O3,一定条件下2个C分子分子间脱去2分子水可生成一种六元环状化合物;D可使溴水褪色;H的三聚物I也是一种六元环状化合物。
提示:葡萄糖在乳酸菌作用下生成乳酸(![]() )。
)。
(1)C→D的反应类型为__,D→E的反应类型为__。
(2)写出A→B反应的化学方程式:_。
(3)H分子中所含官能团的名称是__,实验室中常用于检验该官能团的试剂的名称是_(只写一种)。
(4)写出下列物质的结构简式:高分子化合物F__;六元环状化合物I_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察如图所示装置,可发现电流计指针偏转,M棒变粗,N棒变细.下表所列的M、N、P对应物质可构成该装置的是( )
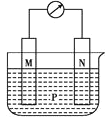
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某油脂A,在稀硫酸作催化剂的条件下水解,生成脂肪酸和多元醇B,B和硝酸在浓硫酸作用下通过酯化反应生成有机物D。
(1)写出油脂A在稀硫酸作催化剂的条件下水解的化学方程式:__。
(2)已知D由C、H、O、N四种元素组成,相对分子质量为227,C、H、N的质量分数分别为15.86%、2.20%和18.50%,则D的分子式是__,B→D的化学方程式是__。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
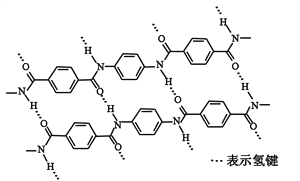
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com