分析:A.锌与浓硫酸、稀硫酸的反应方程式为:Zn+2H
2SO
4(浓)
ZnSO
4+SO
2↑+2H
2O、Zn+H
2SO
4=ZnSO
4+H
2↑,根据方程式判断生成气体的物质的量;
B.标准状况下,四氯化碳为液体,液体的摩尔体积小于22.4L/mol;
C.缺少硝酸银溶液的体积,无法计算溶液中阳离子的物质的量;
D.硫酸浓度越大,密度越大,两溶液的密度不同,混合后溶液浓度小于二者浓度的平均值.
解答:
解:A.浓硫酸与锌反应的方程式为Zn+2H
2SO
4(浓)
ZnSO
4+SO
2↑+2H
2O,0.2mol硫酸能够生成0.1mol二氧化硫气体,随着反应的进行,浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气,反应的方程式为:Zn+H
2SO
4=ZnSO
4+H
2↑,0.2mol硫酸能够失去0.2mol氢气,所以0.2mol锌与浓硫酸充分反应后生成的气体一定大于0.1mol,生成气体的分子数大于0.1N
A,故A错误;
B.标况下,四氯化碳为液体,摩尔体积小于22.4L/mol,则22.4L四氯化碳的物质的量大于1mol,所含分子数大于N
A,故B正确;
C.没有告诉硝酸银溶液的体积,无法计算溶液中阳离子带的电荷数目,故C错误;
D.设0.2mol/L的H
2SO
4的硫酸溶液的密度为x,0.1mol/L的H
2SO
4的硫酸溶液的密度为y,硫酸浓度越大则密度越大,所以x>y,等质量两溶液混合后,设质量为m,则混合液中硫酸的浓度为:
=
mol/L=0.1mol/L+
mol/L,
mol/L=
mol/L,由于x>y,则
mol/L<0.5mol/L,所以0.1mol/L+
mol/L,
mol/L<0.15mol/L,故D错误;
故选B.



 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题: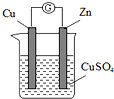 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
某实验兴趣小组按如图装置实验后,所记录内容合理的是( ) 熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2
熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2