
用NA表示阿伏加德罗常数。下列说法中,正确的是
A.2.0g重水(2H2O)中含有的质子数为1.0 NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA
D.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届河南省高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2) 放电的电极反应式为________ ____。
放电的电极反应式为________ ____。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因____ ____。
查看答案和解析>>
科目:高中化学 来源:2015届河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.Al-Mg合金焊接过程中使用的保护气为N2
B.工业上可采用电解熔融NaCl的方法制备金属钠
C.将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ,
则该热化学方程式为N2(g) + 3 H2(g)  2NH3(g) △H= —39.2 KJ·mol-1
2NH3(g) △H= —39.2 KJ·mol-1
D.已知:2H2(g) + O2(g)  2H2O(g) △H= —486 KJ·mol-1 ,则H2 的燃烧热△H为—243 KJ·mol-1
2H2O(g) △H= —486 KJ·mol-1 ,则H2 的燃烧热△H为—243 KJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届河南省名校高三上学期期中考试理综化学试卷(解析版) 题型:选择题
向10mL 0.1mol·L?1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-) >c(Al3+)
B.x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-)
C.x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+)
D.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-) = c(Ba2+)
查看答案和解析>>
科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:填空题
(9分)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)铝元素在周期表中的位置为________。
(2)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。1827 年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) 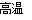 2Al2O3(s)+3Tic(s) △H=-1176kJ/mol。则反应过程中,每转移1 mol电子放出的热量为________。
2Al2O3(s)+3Tic(s) △H=-1176kJ/mol。则反应过程中,每转移1 mol电子放出的热量为________。
(4)硅与铝同周期,地壳里硅铝的含量:硅________铝(填>,<或=)。是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO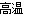 3Ba↑+BaO·Al2O3。利用化学平衡移动原理解释上述方法可制取金属Ba的原因是_____________________________________________________________________________。
3Ba↑+BaO·Al2O3。利用化学平衡移动原理解释上述方法可制取金属Ba的原因是_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
下列操作不能达到目的的是
A.将25gCuSO4·5H2O溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液
B.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体
C.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
D.用银氨溶液鉴别葡萄糖和蔗糖
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:选择题
已知某有机物C6H12O2能发生水解反应生成A和B,B能氧化成C,若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
某溶液中含有下列六种离子:①HCO3- ②SO32- ③Na+ ④CO32- ⑤NH4+⑥NO3—,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是
A.只有⑥ B.④⑥ C.③④⑥ D.①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com