
【题目】以下用于除去乙酸乙酯中乙酸和乙醇杂质的最好试剂是( )
A.饱和碳酸钠溶液B.氢氧化钠溶液C.苯D.水
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德常数,下列说法正确的是
A. 在同温同压时,相同体积的任何气体单质所含的原子数目相同
B. 2g氢气所含原子数目为NA
C. 在常温常压下,11.2L氮气所含的原子数目为NA
D. 17g氨气所含电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去苯中所含的苯酚,可采用的适宜方法是( )
A.加70℃以上的热水,分液
B.加适量浓溴水,过滤
C.加足量NaOH溶液,分液
D.加适量FeCl3溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙酸性质叙述中,错误的是
A.乙酸的酸性比碳酸强,所以它可以和碳酸盐溶液反应生成CO2气体
B.乙酸具有氧化性,能跟金属钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6℃时,就凝结成冰状晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解方程式的书写中,正确的是( )
A.CH3COO﹣的水解方程式:CH3COO﹣+H2O?CH3COOH+OH﹣
B.HCO3﹣的水解方程式:HCO ![]() +H2O?CO
+H2O?CO ![]() +H3O+
+H3O+
C.CO ![]() 的水解方程式:CO
的水解方程式:CO ![]() ?+2H2O?H2CO3+2OH﹣
?+2H2O?H2CO3+2OH﹣
D.Fe3+的水解方程式:Fe3++3OH﹣?Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼是重要的化工原料。可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5℃,熔点为-107.3℃;
②2B+6HCl![]() BCl3+3H2 ,硼也能与强碱反应。
BCl3+3H2 ,硼也能与强碱反应。
某研究性学习小组用如下所示装置制备三氯化硼。回答下列问题:
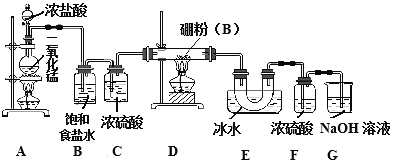
(1)A装置中反应的离子方程式_______________________。
(2)B装置的作用是____________;如果拆去B装置,可能的后果是__________________。
(3)D装置中发生反应的化学方程式_____________。
(4)G装置的作用是_____;为使实验装置简便,可用一个装置代替F和G装置。该装置所用仪器是___,所装试剂是____。
(5)A、D两处加热的先后顺序是_____________,其理由是_______________。
(6)检验制得的产品中是含有硼粉的实验操作是________________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的氯化氢杂质气体 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸 2B+3Cl2
Mn2++Cl2↑+2H2O 除去氯气中的氯化氢杂质气体 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸 2B+3Cl2![]() 2BCl3 吸收未反应完的氯气,防止污染空气 干燥管或U型管 碱石灰 先A处后D处 排尽装置中的空气,避免氧气与硼粉反应生成B2O3 取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉
2BCl3 吸收未反应完的氯气,防止污染空气 干燥管或U型管 碱石灰 先A处后D处 排尽装置中的空气,避免氧气与硼粉反应生成B2O3 取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉
【解析】(1)装置A制取氯气,因此离子反应方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(2)盐酸易挥发,制取的氯气中含有氯化氢,B装置的作用是除去氯气中的氯化氢杂质气体;如果拆去B装置,可能的后果是硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;(3)D装置中发生反应是硼粉与氯气反应生成氯化硼,反应的化学方程式为2B+3Cl2
Mn2++Cl2↑+2H2O;(2)盐酸易挥发,制取的氯气中含有氯化氢,B装置的作用是除去氯气中的氯化氢杂质气体;如果拆去B装置,可能的后果是硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;(3)D装置中发生反应是硼粉与氯气反应生成氯化硼,反应的化学方程式为2B+3Cl2![]() 2BCl3;(4)G装置装有氢氧化钠溶液,其作用是吸收未反应完的氯气,防止污染空气;为使实验装置简便,可用一个装置代替F和G装置,可防止空气中的水蒸气进入E,又能吸收未反应完的氯气,该装置所用仪器是干燥管或U型管,所装试剂是碱石灰;(5)A、D两处加热的先后顺序是先A处后D处,其理由是排尽装置中的空气,避免氧气与硼粉反应生成B2O3;(6)检验制得的产品中是含有硼粉的实验操作是取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
2BCl3;(4)G装置装有氢氧化钠溶液,其作用是吸收未反应完的氯气,防止污染空气;为使实验装置简便,可用一个装置代替F和G装置,可防止空气中的水蒸气进入E,又能吸收未反应完的氯气,该装置所用仪器是干燥管或U型管,所装试剂是碱石灰;(5)A、D两处加热的先后顺序是先A处后D处,其理由是排尽装置中的空气,避免氧气与硼粉反应生成B2O3;(6)检验制得的产品中是含有硼粉的实验操作是取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
【题型】综合题
【结束】
10
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为原料生产重铬酸钠Na2Cr2O7·2H2O,其流程如下:
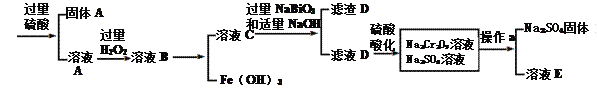
查阅资料得知:
①常温下,NaBiO3难溶于水,有强氧化性。
②常温下,Ksp[Cr(OH)3]=6.4×10-31 Ksp[Fe(OH)3]=4.0×10-38 lg2.5=0.4
③物质溶解度曲线如图所示。
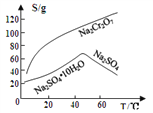
回答下列问题:
(1)Na2Cr2O7·2H2O铬的价态是____,H2O2的电子式为__________。
(2)NaBiO3的作用__________。
(3)滤渣D的成分是__________。
(4)操作a的名称是________、__________。
(5)电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。处理该废水的流程为:

①流程中,Na2S2O3参与反应的的离子方程式__________。
②a=_______,Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1];若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A.寻找合适催化剂提高合成氨工业中原料的转化率
B.对废旧电池进行回收处理,主要是为了环境保护和变废为宝
C.提高油品质量,可以从一定程度上减少雾霾天气
D.含重金属离子的电镀废液不能随意排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验能达到预期目的是( )
A. 检验![]() :先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
:先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
B. 检验NH4+:先滴加NaOH溶液,加热,用湿润蓝色石蕊试纸检验,若变红,则有NH4+
C. 检验Cl—:先滴加AgNO3溶液,再滴加硝酸,若有白色沉淀,则有Cl—
D. 检验![]() :滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有
:滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
A | Mg | 0.1 | 6molL﹣1硝酸 | 10mL | 60℃ |
B | Mg | 0.1 | 3molL﹣1盐酸 | 10mL | 60℃ |
C | Fe | 0.1 | 3molL﹣1盐酸 | 10mL | 60℃ |
D | Mg | 0.1 | 3molL﹣1硫酸 | 10mL | 60℃ |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com