
| A. | 100mL | B. | 150mL | C. | 200mL | D. | 250mL |
分析 先根据混合液“等体积等浓度混合”、“混合液中SO42-浓度为0.4mol/L”计算出混合前三种溶液的物质的量浓度;产生的沉淀量最大时,反应后溶质为硫酸钾,据此可计算出反应后溶液中钾离子的总物质的量,然后根据质量守恒定律确定氢氧化钾的物质的量,最后根据V=$\frac{n}{c}$计算出需要加入的氢氧化钾溶液体积.
解答 解:将硫酸铝、硫酸钾和明矾溶液[KAl(SO4)2]等体积等浓度混合,则混合时三者物质的量相等,设混合前硫酸铝、硫酸铁和明矾溶液[KAl(SO4)2•12H2O]的物质的量浓度都为x,混合液中SO42-浓度为0.4mol/L,则:$\frac{3x+x+2x}{3}$=0.4mol/L,解得:x=0.2mol/L,即混合前三种溶液的浓度都是0.2mol/L,
取100mL混合液,加入0.4mol/L的KOH溶液,产生的沉淀量最大时,此时溶质为硫酸钾,则最终混合液中钾离子的物质的量为:n(K+)=2n(SO42-)=2×0.4mol/L×0.1L=0.08mol,
由于三种溶液为等体积混合,则取出的100mL混合液中含有原三种溶液体积均为:$\frac{0.1L}{3}$,该100mL溶液中含有钾离子的物质的量为:0.2mol/L×$\frac{0.1L}{3}$×2+0.2mol/L×$1×\frac{0.1L}{3}$=0.02mol,
根据钾离子质量守恒,需要加入的氢氧化钾的物质的量为:0.08mol-0.02mol=0.06mol,
所以需要加入0.4mol/L的KOH溶液的体积为:$\frac{0.06mol}{0.4mol/L}$=0.15L=150mL,
故选B.
点评 本题考查了离子方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| B | 向某黄色溶液中加入淀粉KI溶液 | 溶液呈蓝色 | 溶液中含Br2 |
| C | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向久置的Na2SO3溶液中加入足量BaCl2溶液,再加入足最稀盐酸 | 先出现白色沉淀,后部分沉淀溶解 | 部分Na2SO3被氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+的结构示意图: | |
| B. | 氚的原子符号:${\;}_{1}^{2}$H | |
| C. | MgCl2的形成: | |
| D. | Cl2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | 胶体和其他分散系的本质区别是分散质粒子大小不同 | |
| C. | 混合物肯定由两种以上元素组成 | |
| D. | 酸性氧化物一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种 | |
| B. | 1 mol葡萄糖与足量的金属钠反应,最多可生成56LH2 | |
| C. | 三氯甲烷只有一种结构证明甲烷是正四面体构型 | |
| D. | 环己醇 的一氯代物有3种(不含立体结构) 的一氯代物有3种(不含立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 沸点:CH3CH3>CH3CH2OH;密度: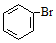 > >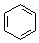 | |
| C. | 苯酚钠溶液中通入少量的CO2离子方程式为:C6H5O-+H2O+CO2→C6H5OH+CO32- | |
| D. | 要检验溴乙烷中的溴元素,向其中加入NaOH溶液共热,冷却后先加硝酸酸化,再加入硝酸银溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列各组物质中,满足图中所示物质一步转化关系的选项是( )
下列各组物质中,满足图中所示物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | Na2CO3 |
| B | Cu | CuCl2 | Cu(OH)2 |
| C | Mg | MgO | MgCl2 |
| D | Al | Al2O3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com