
设C+CO2 2CO(正反应吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1 和v2的变化情况为( )。
2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1 和v2的变化情况为( )。
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C | H—O | C—H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
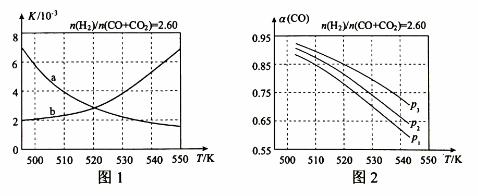
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
2008年北京奥运会火炬以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷。下列说法不正确的是
A.丙烷充分燃烧的产物是水和二氧化碳
B.丙烷燃烧是吸热反应
C.铝柄有一层致密的氧化膜可防止其腐蚀
D.火炬燃料用丙烷比用煤油更环保
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应处于平衡状态时,下列说法正确的是( )。
A.反应不再进行 B.反应物浓度等于生成物浓度
C.反应物质量等于生成物质量 D.各组分浓度不再随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
空气冷却分离是工业上制取大量氮气的主要方法。已知空气各主要成分的沸点如下:
| 气体 | N2 | O2 | Ar | CO2 |
| 沸点 | — 196 ℃ | — 183 ℃ | — 186 ℃ | — 78 ℃ |
若将空气深度冷却液化,然后缓慢升温,沸腾分离,则最先分离出来的气体是( )。
A.O2 B. N2 C.Ar D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol·L-1。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。

(1)容器中气体出现红棕色的原因是(用化学方程式表示)
________________________________________________________________________。
(2)前2 s内,乙容器中以N2O4的浓度变化表示的平均反应速率为____________________。
(3)达到平衡时,甲容器中反应所需的时间______60 s(填“大于”、“小于”或“等于”,下同);两容器中都达到平衡时,N2O4的浓度:甲__________乙,反应过程中吸收的能量:甲__________乙。
(4)两容器都达到平衡后,若要使甲、乙中N2O4浓度相等,不能采取的措施是__________。
A.保持温度不变,适当压缩甲容器
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
D.保持容器体积不变,使甲容器降温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com