
【题目】过氧乙酸是人们常用的一种灭菌消毒剂。
(1)已知过氧化氢的结构式为H—O—O—H,其中的“一O—O—”称为过氧基,过氧乙酸可视为由过氧基取代乙酸分子中羟基上的氧原子而得到的产物。试写出过氧乙酸的结构式___________;
(2)过氧乙酸不稳定,在受热、光照等条件下,可发生分解,放出氧气,易引发火灾或爆炸事故,为防止分解,过氧乙酸应放置在___________处贮藏;
(3)过氧乙酸是一种强氧化剂,它可与乙烯反应生成环氧乙烷(![]() )和乙酸,环氧乙烷经水解可得一种重要的化工原料乙二醇,试分别写出上述两步反应的化学方程式:
)和乙酸,环氧乙烷经水解可得一种重要的化工原料乙二醇,试分别写出上述两步反应的化学方程式:
①_____________________________________________________________________;
②_____________________________________________________________________。
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
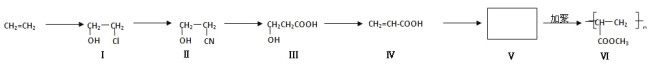
回答下列问题:
(1)化合物Ⅲ中所含官能团的名称是___________________、_______________________。
(2)化合物Ⅲ生成化合物Ⅳ的同时,副产物为____________________________。
(3)CH2=CH2与溴水反应方程式:_______________________________。
(4)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:_____________________。
(5)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是_____________。
A化合物Ⅲ可以发生氧化反应
B化合物Ⅲ不可以与NaOH 溶液反应
C化合物Ⅳ能与氢气发生加成反应
D化合物Ⅲ、Ⅳ均可与金属钠反应生成氢气
E化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
(6)写出化合物Ⅰ与氧气在Cu催化下反应的产物______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同主族元素氢化物的稳定性,自上而下逐渐增强
B.电子结构相同的微粒,它们的化学性质亦相同
C.元素Si、P、S、C1最高价含氧酸的酸性依次增强
D.同周期的短周期元素自左而右原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物CH3-CO-O-CH2-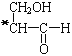 具有光学活性,若将该物质与某物质在一定条件下发生反应,使所得的生成物没有化学活性。根据你设计的反应写出无光学活性生成物的结构简式:__________________、__________________、__________________、__________________。
具有光学活性,若将该物质与某物质在一定条件下发生反应,使所得的生成物没有化学活性。根据你设计的反应写出无光学活性生成物的结构简式:__________________、__________________、__________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
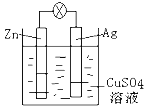
①Zn电极是_______(填“正极”或“负极”),反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),电极反应式为__________。
(2)甲醇(CH3OH)是一种重要的化工原料,在生产中有着重要的应用。甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示:(质子交换膜可以通过H+)
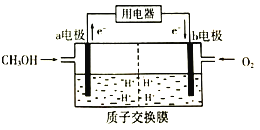
通入甲醇气体的电极为电池的_____(填“正”或“负")极,电解质溶液中H+向_____电极移动(填“a"或“b")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六苯乙烷为白色固体,其结构如下图。下列有关说法中不正确的是 ( )

A. 它是一种芳香烃,易溶于乙醚中
B. 它的分子式为C38H30,是非极性分子
C. 它的一氯代物只有一种
D. 在同一平面上的碳原子最多有14个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的结构与二氧化碳相似,电子式为______________,硫原子的结构示意图______________
(2)羰基硫的氢解和水解反应是两种常用的脱硫方法:
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol
H2S(g)+CO(g) ΔH1=+7kJ/mol
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol
H2S(g)+CO2(g) ΔH2=-34kJ/mol
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
表示CO燃烧热的热化学方程式为________。
(3)氢解反应平衡后保持温度和压强不变通入适量的He,则正反应速率___________,COS的转化率_______(填“增大”、“减小”或“不变”)。
(4)若在绝热、恒容的密闭体系中,投入一定量COS(g)和H2(g),发生氢解反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
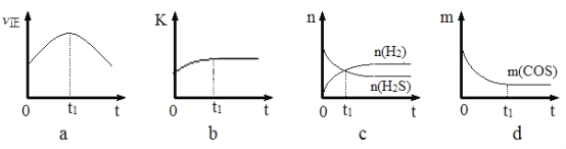
(5)某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,回答下列问题:
①v(H2S)=________mol/(L·min)
②该温度下平衡常数K=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中的位置 。
(2)实验室制取X元素的氢化物的化学方程式为 。
(3)W、Z的最高价氧化物对应的含氧酸的酸性大小顺序 (用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为 。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com