
| A. | 反应KClO3+6HCl═3C12↑+KCl+3H2O,每生成1.5molC12转移电子数为2.5NA | |
| B. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | 1L0.1mol/LNH4Cl溶液中NH4+的数目为0.1NA | |
| D. | 40gSiC中含有Si-C键的数目为2NA |
分析 A.反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,据此解答;
B.11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2?N2O4,则反应后的气体的物质的量小于0,75mol;
C.氨根离子为弱碱阳离子,水溶液中部分水解;
D.分析结构,1mol SiC中含有Si-C键4mol.
解答 解:A.反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,则生成1.5mol氯气转移2.5mol电子,故A正确;
B.11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2?N2O4,则反应后的气体的物质的量小于0,75mol,混合后所含分子数目小于0.75NA,故B错误;
C.氨根离子为弱碱阳离子,水溶液中部分水解,所以溶液中NH4+的数目小于0.1NA,故C错误;
D.40gSiC的物质的量n=$\frac{40g}{40g/mol}$=1mol,而1mol SiC中含有Si-C键4mol即4NA条,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意盐类水解的性质,难度不大.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:多选题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| A. | Na2SO3溶液中c(H+)<c (OH-) | |
| B. | Na2SO3溶液中c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)>c(H+) | |
| C. | 当吸收液呈中性时,c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)=c(H+) | |
| D. | 当吸收液呈中性时,c(Na+)>c (HSO3-)+c (SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 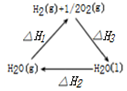 图表示:△H1=△H2+△H3 | |
| B. | 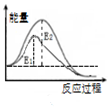 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. | 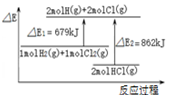 图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 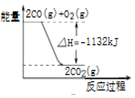 图表示:CO的燃烧热为1132KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -- | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤 | |
| B. | 分离汽油和煤油,可用萃取的方法 | |
| C. | 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
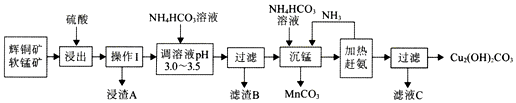
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
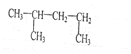
| A. | ②⑤⑥ | B. | ②④ | C. | ④⑤ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com