
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ②③ | D. | ②⑤ |
分析 影响化学平衡移动的因素有温度、浓度和压强,据勒夏特列原理分析,平衡向减弱这种改变的方向移动,据此分析.
解答 解:化学平衡向逆反应方向移动时,
①若增大生成物浓度使平衡逆向移动,增大浓度的生成物的体积分数增大,故错误;
②平衡逆向移动,生成物物质的量减小,反应物的物质的量增多,故正确;
③若增大生成物浓度使平衡逆向移动,生成物的物质的量浓度可能增大,故错误;
④若减小反应物浓度使平衡逆向移动,反应物的物质的量浓度可能减小,故错误;
⑤平衡逆向移动,正反应速率一定小于逆反应速率,故正确;
故选D.
点评 本题考查化学平衡的影响因素,题目难度中等,注意影响化学平衡移动的因素,解答时注意从勒沙特列原理的角度分析.


科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质中仅含C、H、O、N四种元素 | |
| B. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| C. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| D. | 鸡蛋清加入食盐,会使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: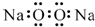 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: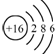 | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和四氯化碳形成的溶液可以用蒸馏的方法来分离 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解是吸热的 | |
| B. | 乙同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸 钠水解是吸热的 | |
| D. | 丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸气)后若红色加深,说明醋酸钠水解是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯制备硝基苯: | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 乙醇通入热的氧化铜中:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
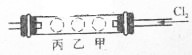 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com