
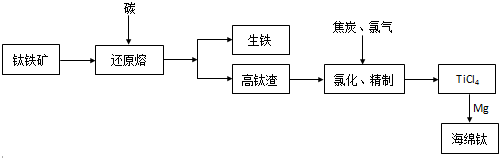
分析 钛铁矿在高温条件下被碳还原,得到生铁和高钛渣(TiO2),高钛渣与碳、氯气高温条件下生成TiCl4,TiCl4用镁还原可知海绵钛,
(1)FeTiO3高温下与等物质的量的碳还原出铁同时生成二氧化钛根据元素守恒和电子得失守恒书写化学方程式;
(2)氯化反应是碳、氯气与二氧化钛的反应,根据元素守恒可知,过程中会产生一种无色可燃性气体应为CO,据此书写化学方程式;
(3)在409K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物应为VOCl2,据此书写反应方程式;
(4)用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,而在此温度下镁、钛都会与氧气反应;金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,而与稀盐酸或稀硫酸等不反应,据此答题;
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO2等,据此答题.
解答 解:钛铁矿在高温条件下被碳还原,得到生铁和高钛渣(TiO2),高钛渣与碳、氯气高温条件下生成TiCl4,TiCl4用镁还原可知海绵钛,
(1)FeTiO3高温下与等物质的量的碳还原出铁同时生成二氧化钛,反应的化学方程式为FeTiO3+C$\frac{\underline{\;<1500K\;}}{\;}$Fe+TiO2+CO,
故答案为:FeTiO3+C$\frac{\underline{\;<1500K\;}}{\;}$Fe+TiO2+CO;
(2)氯化反应是碳、氯气与二氧化钛的反应,根据元素守恒可知,过程中会产生一种无色可燃性气体应为CO,反应的化学方程式为2C+2Cl2+TiO2=$\frac{\underline{\;1073-1273K\;}}{\;}$2CO+TiCl4,
故答案为:2C+2Cl2+TiO2=$\frac{\underline{\;1073-1273K\;}}{\;}$2CO+TiCl4;
(3)在409K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物应为VOCl2,反应的化学方程式为Cu+VOCl3$\frac{\underline{\;409K\;}}{\;}$CuCl+VOCl2,
故答案为:Cu+VOCl3$\frac{\underline{\;409K\;}}{\;}$CuCl+VOCl2;
(4)用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,而在此温度下镁、钛都会与氧气反应,所以反应过程中通入氩气的目的是防止Mg在高温下与空气中O2、CO2等反应,金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,而与稀盐酸或稀硫酸等不反应,所以实验操作为①加入过量的稀盐酸②过滤③洗涤、干燥固体,
故答案为:防止Mg在高温下与空气中O2、CO2等反应;①加入过量的稀盐酸②过滤③洗涤、干燥固体;
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO2等,
故答案为:TiO2+4e-=Ti+2O2-.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.


科目:高中化学 来源: 题型:实验题
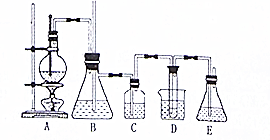 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 445 | 59 | 137 |
| 沸点/℃ | 113 | -122 | -77 |
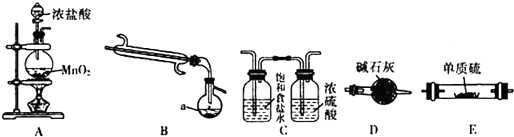
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应②属于置换反应 | |
| B. | 反应②中氯化物的总质量保持不变 | |
| C. | 反应①、②中钛元素的化合价都改变 | |
| D. | 反应②中,氩气只作为保护气并不参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵溶液中含有少量的氯化铁,加入氢氧化钠溶液,过滤 | |
| B. | 用NaOH溶液除去CO中的少量CO2 | |
| C. | 将H2和O2混合气体通过炽热的CuO以除去氧气中的氢气 | |
| D. | H2S气体中含有水蒸气,将混合气体通过含有浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.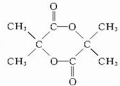 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
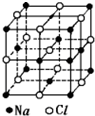 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com