
����Ŀ����˾ƥ��(![]() )���л��ϳɹ����е��м��塣
)���л��ϳɹ����е��м��塣

��֪����.![]()
��.![]() (���н�ǿ�Ļ�ԭ��)
(���н�ǿ�Ļ�ԭ��)
(1)��Ӧ�ܵ��Լ�������Ϊ______����Ӧ�ٵķ�Ӧ����Ϊ______����Ӧ�ڵ�������_____��
(2)B�Ľṹ��ʽΪ_______��
(3)���й���G��������ȷ����______��
A���������ԣ��������ᷴӦҲ����Ӧ
B���ܷ����ӳɡ���ȥ��ȡ����������Ӧ
C���ܾۺϳɸ߷��ӻ�����
D��1molG������NaHCO3��Һ��Ӧ�ų�2molCO2
(4)D��������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ_______����Ӧ�ڵĻ�ѧ����ʽΪ_________��
(5)��������������C��ͬ���칹��
a.���ڷ����廯����Һ���������
b.���ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
���к˴Ź���������4��壬�ҷ����֮��Ϊ6��2��1��1����______________��
���𰸡�Ũ���ᡢŨ���ᡢ���� ȡ����Ӧ �������ǻ����Է������� ![]() AC
AC 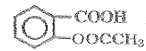 +3NaOH
+3NaOH![]()
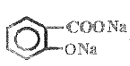 +CH3COONa+2H2O
+CH3COONa+2H2O  +(CH3CO)2O��
+(CH3CO)2O��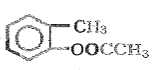 +CH3COOH
+CH3COOH  ��
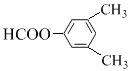
��
��������
��B�ķ���ʽ��D�Ľṹ����֪BΪ![]() ��A��B����������Ϣ�б�������������ȡ����ӦC���������������ᷢ��ȡ����Ӧ����AΪ(CH3CO)2O����CΪ
��A��B����������Ϣ�б�������������ȡ����ӦC���������������ᷢ��ȡ����Ӧ����AΪ(CH3CO)2O����CΪ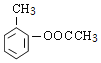 ��C����������Ӧ����D��D�����кͷ�Ӧ��ˮ�ⷴӦ��Ȼ���ữ��õ�EΪ
��C����������Ӧ����D��D�����кͷ�Ӧ��ˮ�ⷴӦ��Ȼ���ữ��õ�EΪ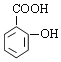 ��E����������Ӧ�õ�F��F������ԭ��Ӧ�õ�G����FΪ
��E����������Ӧ�õ�F��F������ԭ��Ӧ�õ�G����FΪ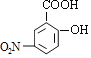 ��
��
(1) ��Ӧ�ܷ���������Ӧ����Ӧ����ΪŨ���ᡢŨ���ᡢ���ȣ��ٵķ�Ӧ����Ϊȡ����Ӧ����Ӧ�ڵ������ǣ��������ǻ�����ֹ��������
(2) �ɷ�����֪��B�Ľṹ��ʽΪ![]() ��
��
(3) A��G�к����Ȼ��Ͱ��������Ծ������Ժͼ��ԣ���������ԣ��������ᷴӦҲ�ܺͼӦ����A��ȷ��
B�����з��ǻ����ܷ���������Ӧ�����ܷ�����ȥ��Ӧ���Ȼ��ܷ���ȡ����Ӧ����B����
C�������Ȼ��ͷ��ǻ��������ܷ������۷�Ӧ���ɸ߷��ӻ������C��ȷ��
D��ֻ���Ȼ��ܺ�̼�����Ʒ�Ӧ���ɶ�����̼������1molG������NaHCO3��Һ��Ӧ�ų�1molCO2����D����
�ʴ�ΪAC��
(4) D��������NaOH��Ӧ�Ļ�ѧ����ʽΪ��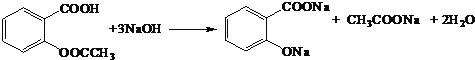 ����Ӧ��Ϊ
����Ӧ��Ϊ![]() ��(CH3CO)2O����ȡ����Ӧ����
��(CH3CO)2O����ȡ����Ӧ����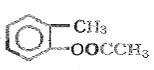 ��������Ӧ�Ļ�ѧ����ʽΪ
��������Ӧ�Ļ�ѧ����ʽΪ +(CH3CO)2O��
+(CH3CO)2O��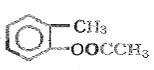 +CH3COOH��
+CH3COOH��
(5) CΪ![]() ��C��ͬ���칹��������������������ڷ����廯����Һ���2������˵�����б������ڼ��ܷ���������Ӧ���ܷ���ˮ�ⷴӦ��˵������HCOO-��������������ͬ���칹�干����3��ȡ������1��HCOO-��2��-CH3�����������CH3λ����λ��HCOO-��λ�ù���2�֣��������-CH3λ�ڼ�λ��HCOO-��λ�ù���3�֣��������-CH3λ�ڶ�λ��HCOO-��λ��ֻ��1�֣����к˴Ź���������4��壬�ҷ����֮��Ϊ6��2��1��1����
��C��ͬ���칹��������������������ڷ����廯����Һ���2������˵�����б������ڼ��ܷ���������Ӧ���ܷ���ˮ�ⷴӦ��˵������HCOO-��������������ͬ���칹�干����3��ȡ������1��HCOO-��2��-CH3�����������CH3λ����λ��HCOO-��λ�ù���2�֣��������-CH3λ�ڼ�λ��HCOO-��λ�ù���3�֣��������-CH3λ�ڶ�λ��HCOO-��λ��ֻ��1�֣����к˴Ź���������4��壬�ҷ����֮��Ϊ6��2��1��1����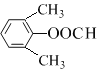 ��
��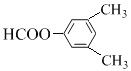 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܶຬ�Ȼ����ﶼ����Ҫ��Ư��
������������(NaClO2)��һ�ֳ���Ư����ij̽��С�鿪չ����ʵ�飬�ش��������⣺
��ȡNaClO2���尴����ͼװ�ý�����ȡ��

��֪��NaClO2������Һ�ڵ���38��ʱ����NaClO23H2O������38��ʱ����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��
(1)װ��C��������_____________��
(2)��֪װ��B�еIJ�����ClO2���壬��װ��D�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ___________________��װ��B�з�Ӧ�����Һ�������ӳ���ClO2����ClO3����Cl����ClO����OH������ܺ��е�һ����������______����������ӵķ�����____________________��
(3)�벹���װ��D��Ӧ�����Һ�л��NaClO2����IJ������衣
�ټ�ѹ��55�������ᾧ����________������38����60����ˮϴ�ӣ��ܵ���60������õ���Ʒ��
(4)�����ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е�������_______________��
����ClO2Ҳ��һ�ֳ���Ư������ClO2������������ˮ������һ�����к���ClO![]() ���ҹ��涨����ˮ��ClO
���ҹ��涨����ˮ��ClO![]() �ĺ���Ӧ������0.20 mg��L��1���ⶨˮ����ClO2��ClO
�ĺ���Ӧ������0.20 mg��L��1���ⶨˮ����ClO2��ClO![]() �ĺ����Ĺ������£�
�ĺ����Ĺ������£�
����ȡ25.00 mLˮ�����뵽��ƿ�У�������ˮ����pHΪ7.0��8.0��
�ڼ���������KI���塣�˹��̷�����Ӧ2ClO2��2I��===2ClO![]() ��I2��
��I2��
�ۼ�������������Һ������������Һ�еμ�1.00��10��3 mol��L��1 Na2S2O3��Һ����Һ��ɫ�պ���ȥ������Na2S2O3��Һ7.45 mL���˹��̷�����Ӧ��2S2O![]() ��I2===S4O
��I2===S4O![]() ��2I����
��2I����
�ܵ��ڵڢ۲�������Һ��pH��2.0���˹��̷�����ӦClO![]() ��4H����4I��===Cl����2I2��2H2O��
��4H����4I��===Cl����2I2��2H2O��
��������Һ�еμ�1.00��10��3 mol��L��1 Na2S2O3��Һ����ɫ�պ���ȥ������Na2S2O3��Һ30.00 mL
�����������ݼ��㲢�жϸ�ˮ����ClO![]() �ĺ����Ƿ���Ϲ��ҹ涨��
�ĺ����Ƿ���Ϲ��ҹ涨��
______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ�����к���CO��N2��SO2�����壬��Na2SO3��Һ���ղ�����SO2�Ĺ�����ͼ��ʾ��

(1)SO2��Ũ�ȣ���______������>������<������
(2)ͼʾ�����п���ѭ�����õ�������______���ѧʽ����
(3)�������չ����з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��______��
(4)����������Ҫ���ȣ�����������г���������SO42-������
��֤�������к�SO42-��ʵ�鷽���ǣ�ȡ�������������Һ��______�������������
�ڲ���SO42-��ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʪ��Cl2ͨ����ͼ��ʾװ���У�һ��ʱ�����װ���к�ɫ���ﲼ����ɫ�����װ������ʢ�Լ��������������ǣ� ��
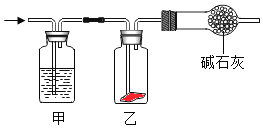
A.Ũ����B.NaOH��ҺC.KI��ҺD.����ʳ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��Һ��ɫ��Ӧʱ���������ʻ�ɫ��˵������Һһ������Ԫ�أ�һ��û�м�Ԫ��
B. ��ȥCO2�е�HCl���壬ֻ�轫����ͨ��NaOH��Һ
C. ��ij��Һ�еμ������ữ���Ȼ�����Һ���а�ɫ�������ɣ�˵����Һ��һ����SO![]()
D. ��������ԭ��Ӧ�У�������Ҳ��ʧȥ���ӱ�������������Ҳ�ܵõ����ӱ���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������Һ X �п��ܺ��� Fe2����Fe3����Al3����Ba2����NH4����CO32����NO3����SO42����SiO32���е������֣���ȡ X ��Һ��������ʵ�飬ʵ����̼�������ͼ��ʾ��ʵ���������һ������Ϊ����ɫ��

����������Ϣ���ش��������⣺
��1����ǿ�������������ж� X ��Һ�п϶������ڵ�������_____��
��2����Һ X �й�����������ӵ��жϣ���ȷ����_____(���ţ���ͬ)��
a��һ������ b��һ�������� c�����ܺ���
��3������ F �ĵ���ʽΪ_____�������� I �к��еĻ�ѧ��������_____��
��4��ת���ٵ����ӷ���ʽΪ_____�� ת���ߵ����ӷ���ʽΪ_________��
��5���Բ���ȷ���Ƿ���ڵ����ӣ�������ȡ X ��Һ������������Һ�е�һ�֣����������жϣ� ���Լ������_____��
��NaOH ��Һ ��KSCN ��Һ ����ˮ�� KSCN �Ļ����Һ ��pH ��ֽ ��KMnO4 ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̼��仯������;�㷺������������֡��Ͻ�֡����̺Ͻ�ͭ�̺Ͻ�ȵĺϽ�Ԫ�أ����������ҽ������������������Ҳ�������ڶ���ø�����Ԫ�ء�
(1)������KMnO4��Һ�������εķ�Ӧ֤��Fe2�����л�ԭ�ԡ�MnO![]() ���������ԣ�����ʵ���������________[����FeSO4������FeCl2������Fe(NO3)2����ѡ������]��
���������ԣ�����ʵ���������________[����FeSO4������FeCl2������Fe(NO3)2����ѡ������]��
(2)��ҵ���ɶ�������ͨ�����ȷ�Ӧ�Ʊ��̣�д����Ӧ�Ļ�ѧ����ʽ��________________________��
(3)�����ʵ�����Al��Mn�ֱ���������ϡ���ᷴӦ������H2�������(ͬ��ͬѹ)Ϊ3��2��д��Mn��ϡ���ᷴӦ�Ļ�ѧ����ʽ��________________________��
(4)�����ڵ�Mn��KOH�������ͨ��O2���Ʊ�K2MnO4������MnO2����MnҲ���Ƶ�K2MnO4������������Ʊ���ͬ����K2MnO4����O2�����ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ҫ�Ľ��������ǵĵ��ʼ����������Ÿ��Ե����ʡ���һ���¶��£�������������һ����̼�������з�Ӧ��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)��
2Fe(s)+3CO2(g)��
��1���ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ��K=___��
�ڸ��¶��£���2Lʢ��Fe2O3��ĩ���ܱ�������ͨ��CO���壬10min�������˵�����11.2g����10min��CO��ƽ����Ӧ����Ϊ___��
��2������������Ӧ��ij��������й���������˵���÷�Ӧ�Ѵﵽƽ��״̬����___��___��
��3������KAl(SO4)2��12H2O��ˮ��Һ��___�ԣ�����ԡ����ԡ����ԣ�����Һ�и����ӵ�Ũ�ȴӴ�С��˳��Ϊ____��
��4��д������������ˮ�з�����ʽ����ĵ��뷽��ʽ��___����ʹ������ϵ��Al3+Ũ�����ӣ��ɼ����������____��
��5��ijЩ�����������ĩ��Al����þ������ȼ�¿��Է������ȷ�Ӧ�����з�Ӧ����(v)���¶�(T)�Ĺ�ϵʾ��ͼ�������ȷ�Ӧ��ӽ�����____��
a. b.
b. c.
c. d.
d.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Journal of Energy Chemistry����־�������ҹ���ѧ����Ƶ�CO2���β�����ת��װ�ã���ʾ��ͼ���£�
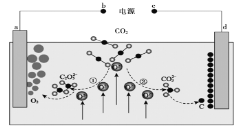
�����й�˵����ȷ����( )
A.d����
B.�٢��У�����CO2ʱ̼Ԫ�صĻ��ϼ۷����˱仯
C.ת��1 mol���ӿɲ���CO2����22��4 L
D.a���缫��ӦʽΪ![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com