
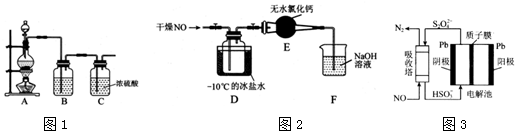
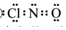
分析 (1)根据装置固液加热型选择药品分析;
(2)①NOCl分子中各原子均满足8电子稳定结构,则氮原子与氧原子形成两对共用电子对,与氯原子形成一对;
②装置D中由黄绿色的氯气生成了红褐色液体NOCl;
③根据NOCl遇水易分解,故装置中应无水分析;
④NO不溶于水,可与氧气一同通入氢氧化钠吸收;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气.
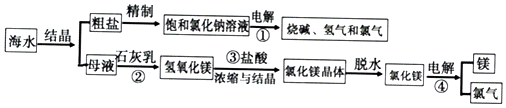
解答 解(1)图1为固液加热型,
①制NO时,可选用铜与稀硝酸制取,发送的反应方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
②制Cl2时,可选用二氧化锰和浓盐酸,制得的氯气中有氯化氢气体,用饱和食盐水除去;
故答案为:饱和食盐水;除去氯气中的氯化氢气体;
(2)①NOCl分子中各原子均满足8电子稳定结构,则氮原子与氧原子形成两对共用电子对,与氯原子形成一对,电子式为: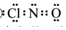 ;
;
故答案为: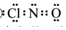 ;
;
②装置D中为氯气制备NOCl,故现象为黄绿色气体逐渐变浅,有红褐色液体生成;
故答案为:黄绿色气体逐渐变浅,有红褐色液体生成;
③NOCl遇水易分解,装置E中无水氯化钙的作用为吸收水蒸气,防止水蒸气进入D装置;
故答案为:吸收水蒸气,防止水蒸气进入D装置;
④NO不溶于水,可与氧气一同通入氢氧化钠吸收,、;
故答案为:O2;
(3)①阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;
故答案为:2HSO3-+2e-+2H+═S2O42-+2H2O;
②硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O═N2+4HSO3-;
故答案为:2NO+2S2O42-+2H2O═N2+4HSO3-.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际七个基本物理量之一 | |
| B. | 含NA个O原子的O2物质的量为0.5mol | |
| C. | 6.02×1023个任何物质的量均为1mol | |
| D. | 1mol氢含有6.02×1023个氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 |
| A | 硅单质 | 制作光导纤维 |
| B | 烧碱 | 治疗胃酸过多 |
| C | 铁罐车 | 常温下用于运输浓硝酸 |
| D | 液氨 | 用作消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性a>b | |
| B. | a与b只能形成两种化合物:ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | d与a元素能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
某蓄电池放电、充电时的反应为
Fe+Ni2O3+3H2O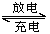 Fe(OH)2+2Ni(OH)2下列推断中正确的是
Fe(OH)2+2Ni(OH)2下列推断中正确的是
①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-==Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com