
某酸式盐NaHY的水溶液显碱性,下列叙述正确的是
( )
A.H2Y的电离方程式:H2Y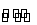 2H++Y2-
2H++Y2-
B.HY-的水解方程式:HY-+H2O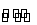 H3O++Y2-
H3O++Y2-
C.该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+]
D.该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
依据叙述,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、
391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应2A(g)+B(g) C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH>0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是_________。
(2)火箭残骸中常出现红棕色气体,是因为:N2O4(g)  2NO2(g) (Ⅱ)
2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为____________(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下 列示意图正确且能说明反应达到平衡状态的是__________。
列示意图正确且能说明反应达到平衡状态的是__________。
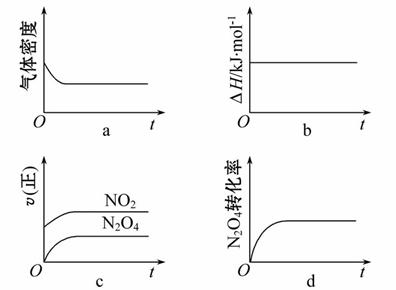
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ______mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
向AgCl饱和溶液中滴加足量NaBr溶液,产生淡黄色沉淀,再向溶液中滴加KI溶液,又产生黄色沉淀。有关下列说法正确的是( )
A.产生的淡黄色沉淀为AgI
B.产生的黄色沉淀为AgBr
C.由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl)
D.上述实验现象说明沉淀之间可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
夏天,鸡没有汗腺只能依赖“喘息”调节体温。鸡过度地呼出CO2,使下列平衡向左移动导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。
CO2(g)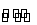 CO2(aq),
CO2(aq),
CO2(aq)+H2O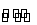 H2CO3(aq)
H2CO3(aq)
H2CO3(aq)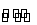 H+(aq)+HCO3- (aq),
H+(aq)+HCO3- (aq),
HCO3- (aq)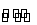 H+(aq)+CO32- (aq)
H+(aq)+CO32- (aq)
Ca2+(aq)+CO32- (aq)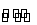 CaCO3(s)(蛋壳)
CaCO3(s)(蛋壳)
澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料是( )
A.淡盐水 B.碳酸水
C.蔗糖 D.澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来测定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH====KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为测定N aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1滴~2滴指示剂; ②向锥形瓶中加20 mL~30 mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.400 0 g~0.600 0 g邻苯二甲酸氢钾加入到250 mL锥形瓶中;⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是__________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?________________________________________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果__________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份质量均为0.510 5 g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00 mL,则NaOH溶液的物质的量浓度是多少?(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①Zn(s)+1/2O2(g)===ZnO(s) ΔH1;②Hg(l)+1/2O2(g)===HgO(s) ΔH2。则反应Zn(s)+HgO(s)===Hg(l)+ZnO(s)的ΔH为( )
A.ΔH1-ΔH2 B.ΔH2-ΔH1
C.ΔH1+ΔH2 D.-(ΔH1+ΔH2)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列叙述中错误的是( )
|
| A. | 1mol Al3+含有的核外电子数为10NA |
|
| B. | 1mol Na与足量O2反应,无论生成Na2O或Na2O2均失去NA个电子 |
|
| C. | 标准状况下,2.24L乙醇中所含分子数约为0.1NA |
|
| D. | 1L 0.1mol/L的盐酸中,含0.1NA个Cl﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com